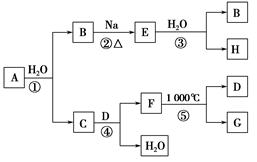
题目内容
实验室测定含碘废液中I-的含量以及碘的回收过程如下:
Ⅰ.含碘废液中I-含量的测定
用移液管量取25.00 mL废液于250 mL锥形瓶中,分别加入5 mL 2 mol·L-1 H2SO4和10 mL 20% NH4Fe(SO4)2·12H2O溶液,摇匀。小火加热蒸发至碘完全升华,取下锥形瓶冷却后,加入10 mL 2 mol·L-1H2SO4,加入几滴二苯胺磺酸钠(用作指示剂),用0.0250 mol·L-1标准K2Cr2O7溶液进行滴定至终点。重复3次,数据记录如下表:
(已知反应:①2Fe3++2I-=2Fe2++I2 ②6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O)
Ⅱ.碘的回收
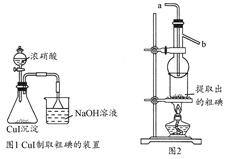
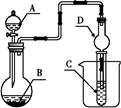
取250 mL含碘废液于烧杯中加入按上述计算所需的Na2S2O3溶液,并将CuSO4饱和溶液在不断搅拌下滴加到废液中,加热至70℃左右完全反应(已知:2I-+2Cu2++2S2O32-=2CuI↓+S4O62-)。过滤,得到的沉淀按图1进行操作。检查装置的气密性后,从分液漏斗中逐滴加入浓硝酸(注意滴液的速度)完全反应后,通过减压过滤,得到粗碘固体产品和抽滤液。然后按图2进行粗碘的提纯。
回答下列问题:
(1)用移液管量取废液时,将移液管竖直放入稍倾斜的锥形瓶中,接着的操作是______________________________________,数秒后,取出移液管。
(2)在盛有废液的锥形瓶中先加入5 mL 2 mol·L-1 H2SO4的目的是__________________________。
(3)根据滴定有关数据,该废液中I-含量是________g·L-1。
在滴定过程中,下列操作(其他操作正确)会造成测定结果偏低的是_____。
A.终点读数时俯视读数,滴定前平视读数
B.锥形瓶水洗后未干燥
C.滴定管未用标准K2Cr2O7溶液润洗
D.盛标准K2Cr2O7溶液的滴定管,滴定前有气泡,滴定后无气泡
(4)在图1锥形瓶中发生反应的化学方程式是____________________。
(5)按图2装置进行粗碘提纯,采用的分离方法是________,a、b为冷凝水进出口,其中________(选填a或b)接水龙头进水。最终得到较高纯度的单质碘。
Ⅰ.含碘废液中I-含量的测定
用移液管量取25.00 mL废液于250 mL锥形瓶中,分别加入5 mL 2 mol·L-1 H2SO4和10 mL 20% NH4Fe(SO4)2·12H2O溶液,摇匀。小火加热蒸发至碘完全升华,取下锥形瓶冷却后,加入10 mL 2 mol·L-1H2SO4,加入几滴二苯胺磺酸钠(用作指示剂),用0.0250 mol·L-1标准K2Cr2O7溶液进行滴定至终点。重复3次,数据记录如下表:
(已知反应:①2Fe3++2I-=2Fe2++I2 ②6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O)
| 次数 | 1 | 2 | 3 |
| 滴定体积(mL) | 19.60 | 19.65 | 19.55 |
Ⅱ.碘的回收
取250 mL含碘废液于烧杯中加入按上述计算所需的Na2S2O3溶液,并将CuSO4饱和溶液在不断搅拌下滴加到废液中,加热至70℃左右完全反应(已知:2I-+2Cu2++2S2O32-=2CuI↓+S4O62-)。过滤,得到的沉淀按图1进行操作。检查装置的气密性后,从分液漏斗中逐滴加入浓硝酸(注意滴液的速度)完全反应后,通过减压过滤,得到粗碘固体产品和抽滤液。然后按图2进行粗碘的提纯。

回答下列问题:
(1)用移液管量取废液时,将移液管竖直放入稍倾斜的锥形瓶中,接着的操作是______________________________________,数秒后,取出移液管。
(2)在盛有废液的锥形瓶中先加入5 mL 2 mol·L-1 H2SO4的目的是__________________________。
(3)根据滴定有关数据,该废液中I-含量是________g·L-1。
在滴定过程中,下列操作(其他操作正确)会造成测定结果偏低的是_____。
A.终点读数时俯视读数,滴定前平视读数
B.锥形瓶水洗后未干燥
C.滴定管未用标准K2Cr2O7溶液润洗
D.盛标准K2Cr2O7溶液的滴定管,滴定前有气泡,滴定后无气泡
(4)在图1锥形瓶中发生反应的化学方程式是____________________。
(5)按图2装置进行粗碘提纯,采用的分离方法是________,a、b为冷凝水进出口,其中________(选填a或b)接水龙头进水。最终得到较高纯度的单质碘。
(1)管尖与锥形瓶内壁接触,松开食指使溶液全部流出
(2)抑制Fe3+水解
(3)14.94(14.93~14.95均可给分) A
(4)2CuI+8HNO3=2Cu(NO3)2+4NO2↑+I2+4H2O
(5)升华法 a
(2)抑制Fe3+水解
(3)14.94(14.93~14.95均可给分) A
(4)2CuI+8HNO3=2Cu(NO3)2+4NO2↑+I2+4H2O
(5)升华法 a
(1)使用移液管时,应使管尖与锥形瓶内壁接触,然后松开食指使溶液全部流出。(2)加入稀硫酸是为了抑制Fe3+的水解。(3)由反应①、②可得出如下关系式:6I-~Cr2O72-,滴定消耗标准液K2Cr2O7溶液的体积V=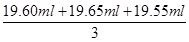 =19.60 mL,则:c(I-)×0.025 0 L=6×0.0250 mol·L-1×0.01960 L,解得c(I-)=0.1176 mol·L-1,则废液中I-的含量为0.1176mol·L-1×127 g·mol-1≈14.94 g·L-1。A项,滴定终点时俯视读数,滴定前平视读数,会造成标准液体积偏小而导致测定结果偏低;B项,对测定结果无影响;C项,标准液被稀释,造成滴定时所用体积偏大而使测定结果偏高;D项,标准液滴定前有气泡,滴定后无气泡,使标准液读取体积偏大,使测定结果偏高。故选A。(4)CuI中Cu+和I-均可被浓HNO3氧化,根据得失电子守恒、原子守恒可写出:2CuI+8HNO3=2Cu(NO3)2+4NO2↑+I2+4H2O。(5)图2是利用升华法提纯碘,冷凝水应从a口进,使碘蒸气更易凝结为固体碘。
=19.60 mL,则:c(I-)×0.025 0 L=6×0.0250 mol·L-1×0.01960 L,解得c(I-)=0.1176 mol·L-1,则废液中I-的含量为0.1176mol·L-1×127 g·mol-1≈14.94 g·L-1。A项,滴定终点时俯视读数,滴定前平视读数,会造成标准液体积偏小而导致测定结果偏低;B项,对测定结果无影响;C项,标准液被稀释,造成滴定时所用体积偏大而使测定结果偏高;D项,标准液滴定前有气泡,滴定后无气泡,使标准液读取体积偏大,使测定结果偏高。故选A。(4)CuI中Cu+和I-均可被浓HNO3氧化,根据得失电子守恒、原子守恒可写出:2CuI+8HNO3=2Cu(NO3)2+4NO2↑+I2+4H2O。(5)图2是利用升华法提纯碘,冷凝水应从a口进,使碘蒸气更易凝结为固体碘。
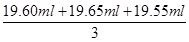 =19.60 mL,则:c(I-)×0.025 0 L=6×0.0250 mol·L-1×0.01960 L,解得c(I-)=0.1176 mol·L-1,则废液中I-的含量为0.1176mol·L-1×127 g·mol-1≈14.94 g·L-1。A项,滴定终点时俯视读数,滴定前平视读数,会造成标准液体积偏小而导致测定结果偏低;B项,对测定结果无影响;C项,标准液被稀释,造成滴定时所用体积偏大而使测定结果偏高;D项,标准液滴定前有气泡,滴定后无气泡,使标准液读取体积偏大,使测定结果偏高。故选A。(4)CuI中Cu+和I-均可被浓HNO3氧化,根据得失电子守恒、原子守恒可写出:2CuI+8HNO3=2Cu(NO3)2+4NO2↑+I2+4H2O。(5)图2是利用升华法提纯碘,冷凝水应从a口进,使碘蒸气更易凝结为固体碘。
=19.60 mL,则:c(I-)×0.025 0 L=6×0.0250 mol·L-1×0.01960 L,解得c(I-)=0.1176 mol·L-1,则废液中I-的含量为0.1176mol·L-1×127 g·mol-1≈14.94 g·L-1。A项,滴定终点时俯视读数,滴定前平视读数,会造成标准液体积偏小而导致测定结果偏低;B项,对测定结果无影响;C项,标准液被稀释,造成滴定时所用体积偏大而使测定结果偏高;D项,标准液滴定前有气泡,滴定后无气泡,使标准液读取体积偏大,使测定结果偏高。故选A。(4)CuI中Cu+和I-均可被浓HNO3氧化,根据得失电子守恒、原子守恒可写出:2CuI+8HNO3=2Cu(NO3)2+4NO2↑+I2+4H2O。(5)图2是利用升华法提纯碘,冷凝水应从a口进,使碘蒸气更易凝结为固体碘。
练习册系列答案
相关题目
 3SO2↑+2H2O,在此反应中,浓硫酸既表现了其强氧化性又表现了其酸性
3SO2↑+2H2O,在此反应中,浓硫酸既表现了其强氧化性又表现了其酸性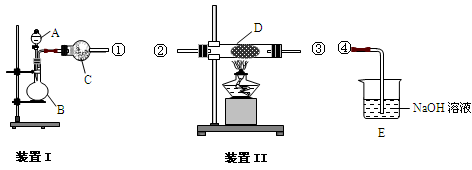
 淀粉溶液,则C中溶液变蓝
淀粉溶液,则C中溶液变蓝