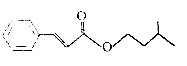
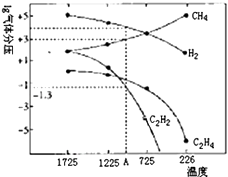
��Ŀ����
����Ŀ����һ���������� X ����ij 10L �ݻ��㶨����������У������������������Բ��ƣ����ں㶨�¶���ʹ��ﵽ�ֽ�ƽ�⣺X��s��2Y��g��+Z��g����ʵ���ò�ͬ�¶��µķֽ�ƽ�ⳣ���������������˵���в���ȷ���ǣ� ��
�¶ȣ� | 15.0 | 25.0 | 30.0 | 35.0 |
K/����10��8 mol3L��3�� | 0.205 | 1.64 | 4.68 | 10.8 |
A.��Z���������������ʱ��仯ʱ��ʾ��Ӧ��ƽ��״̬
B.35 ![]() ʱ����ƽ��ʱ��X�ֽ��� 0.03 mol
ʱ����ƽ��ʱ��X�ֽ��� 0.03 mol
C.�÷�Ӧ�ڸ����¿����Է�
D.���ں����£�ѹ������������ٴδ�ƽ���n��X����ԭƽ���
���𰸡�A
���������⣺A����ӦX��s��2Y��g��+Z��g���У�Y��Z�������壬��X�ǹ��壬����Z���������ʼ�ղ���ʱ��仯���仯������Z���������������ƽ��״̬�ı�־����A����B��35��ƽ�ⳣ��Ϊ10.8��
X��s�� | 2Y��g��+ | Z��g�� | ||
��ʼ���� | a | 0 | 0 | |
�仯���� | b | 2b | b | |
ƽ������ | a��b | 2b | b |
����K= ![]() =10.8����֮��b=0.03 mol����B��ȷ��
=10.8����֮��b=0.03 mol����B��ȷ��
C���ɱ���֪�¶�Խ�ߣ�ƽ�ⳣ��KԽ�����Է�ӦX��s��2Y��g��+Z��g����H��0����S��0�����ݡ�G=��H��T��S��ֻ���ڸ��µ������·�Ӧ���Է����У���C��ȷ��
D��ѹ������������൱������ѹǿ��ƽ�������ƶ��������ٴδ�ƽ���n��X����ԭƽ���D��ȷ��
��ѡA��
�����㾫����������Ĺؼ��������⻯ѧƽ��״̬���ʼ����������֪ʶ�����ջ�ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч����

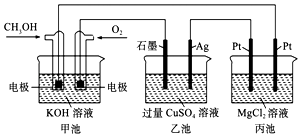
 �߲������Ӧ��һ��ͨϵ�д�
�߲������Ӧ��һ��ͨϵ�д�����Ŀ��ijС��ͬѧΪ̽�����ʵ�������ǿ�����������ʵ�飨�г���������ȥ��װ�õ��������Ѽ��飩��
��֪������ˮΪ���ˮ��Һ����ˮΪ�Ȼ�ɫ��������Ϊ����ɫ�����ж�
����ˮΪ������ˮ��Һ��
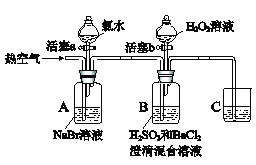
ʵ���¼���£�
ʵ����� | ʵ������ | |
�� | ����a���μ���ˮ���رջ���a | A����Һ��Ϊ�Ȼ�ɫ |
�� | �����ȿ��� | A�гȻ�ɫ���Ա�dz��B�������ݣ�����������ɫ���������Һ��ɫ�����Ա仯 |
�� | ֹͣ�������������b����μ���H2O2��Һ | ��ʼʱ��ɫ�����Ա仯�������μ�H2O2��Һ��һ��ʱ����Һ��ɳȻ�ɫ |
��ش��������⣺
��1��A�з�Ӧ�����ӷ���ʽ��__________________________________________��
��2��ʵ�����II�����ȿ�����Ŀ����___________________________________��
��3��װ��C��������_____________________________________��
��4��ʵ�����III�����Һ��ɳȻ�ɫ�����Ӧ�����ӷ���ʽ��____________��
��5���ɲ���I�ó��Ľ�����_____________���ɲ���III�ó��Ľ�����______________��
��6��ʵ�鷴˼��ʵ�����III����ʼʱ��ɫ�����Ա仯��ԭ���ǣ�д��һ�����ɣ���___________��