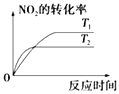
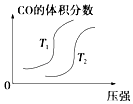
题目内容
【题目】常温下,将一定量的钠铝合金置于水中,合金全部溶解,所得的溶液中仍含有0.02mol的NaOH ,然后向溶液中逐滴加入lmol/L的盐酸,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法正确的是( )
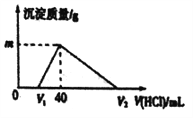
A. 原合金质量为0.92g B. 图中V2的值为60mL
C. 产生氢气的体积为1120mL D. 图中m的值为1.56g
【答案】D
【解析】反应后所得的溶液中仍含有0.02mol的NaOH,所以需要1mol/L的盐酸20mL来中和,因此V1为20mL,继续加盐酸发生AlO2-+H++H2O=Al(OH)3,Al(OH)3+3H+=Al3++3H2O,因此沉淀AlO2-用掉20mL盐酸,溶解Al(OH)3用掉60mL盐酸,所以V2为100mL,(选项B错误);所以Al(OH)3为0.02mol,则m为1.56g,(选项D正确);原混合物中含有Al为0.54g,当盐酸加100mL时,溶液中的溶质为NaCl和AlCl3,又知n(Cl-)=0.1mol,n(Al3+)=0.02mol,所以n(Na+)=0.04mol。所以原混合物中有Na为0.04mol,质量为0.92g,所以原混合物的质量为0.92g+0.54g=1.46g(选项A错误)。反应过程中产生氢气0.05mol,标准状况下为1120mL(题中没给定标准状况下,选项C错误)。答案选D。

【题目】将一定量纯净的 X 置于某 10L 容积恒定的真空容器中(假设固体试样体积忽略不计),在恒定温度下使其达到分解平衡:X(s)2Y(g)+Z(g),实验测得不同温度下的分解平衡常数列于如表,下列说法中不正确的是( )
温度( | 15.0 | 25.0 | 30.0 | 35.0 |
K/(×10﹣8 mol3L﹣3) | 0.205 | 1.64 | 4.68 | 10.8 |
A.若Z的体积分数不再随时间变化时表示反应达平衡状态
B.35 ![]() 时,达平衡时,X分解了 0.03 mol
时,达平衡时,X分解了 0.03 mol
C.该反应在高温下可能自发
D.若在恒温下,压缩容器体积,再次达平衡后,n(X)比原平衡大