题目内容
【题目】由中学化学常见元素组成的单质A、B、C和甲、乙、丙、丁、戊五种化合物有下图所示转化关系,A是由地壳中含量最多的金属元素组成的。请回答:
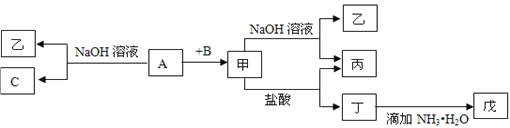
(1)写出下列物质的化学式:乙_______、丁_______、戊_______。
(2)写出甲物质在工业上的一种主要用途:______________________________。
(3)写出甲→乙+丙反应的离子方程式:______________________________________;
丁→戊反应的离子方程式:___________________________________________;
A→乙+C反应的化学方程式_____________________________________________。
【答案】 NaAlO2 AlCl3 Al(OH)3 耐火材料 Al2O3+2OH-=2AlO2-+H2O Al3+ + 3NH3·H2O=Al(OH)3+3NH4+ 2Al+2NaOH+2H2O=2NaAlO2+3H2↑
【解析】地壳中含量最多的金属元素是Al,故A为Al。A与NaOH反应生成NaAlO2和H2,故C为H2,乙为NaAlO2。A与B反应生成的甲可以和NaOH、盐酸反应,则B为O2,甲为Al2O3,则丙为H2O,丁为AlCl3,戊为Al(OH)3。(1)乙的化学式为:NaAlO2、丁的化学式为:AlCl3、戊的化学式为:Al(OH)3;(2)甲为Al2O3,可用作耐火材料;(3)甲→乙+丙反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O;丁→戊反应的离子方程式为:Al3+ + 3NH3·H2O=Al(OH)3+3NH4+;A→乙+C反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑。

【题目】将一定量纯净的 X 置于某 10L 容积恒定的真空容器中(假设固体试样体积忽略不计),在恒定温度下使其达到分解平衡:X(s)2Y(g)+Z(g),实验测得不同温度下的分解平衡常数列于如表,下列说法中不正确的是( )
温度( | 15.0 | 25.0 | 30.0 | 35.0 |
K/(×10﹣8 mol3L﹣3) | 0.205 | 1.64 | 4.68 | 10.8 |
A.若Z的体积分数不再随时间变化时表示反应达平衡状态
B.35 ![]() 时,达平衡时,X分解了 0.03 mol
时,达平衡时,X分解了 0.03 mol
C.该反应在高温下可能自发
D.若在恒温下,压缩容器体积,再次达平衡后,n(X)比原平衡大
【题目】以工业废铁屑为原料生产氧化铁红颜料并进行适当的综合利用,其主要流程如图: 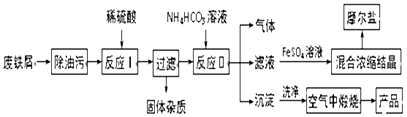
已知:FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的悬浊液.
(1)写出在空气中煅烧沉淀的化学反应方程式: .
(2)本流程中产生的CO2和H2 , 在催化剂作用下按体积比1:1合成一种重要的有机化工原料R,该合成符合绿色化学要求.已知液体R的燃烧热为254.6 kJ/mol,则R完全燃烧的热化学方程式为
(3)在FeSO4溶液中加入(NH4)2SO4固体可制备摩尔盐晶体[(NH4)2SO4FeSO46H2O](相对分子质量392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇.
①为洗涤(NH4)2SO4FeSO46H2O粗产品,下列方法中最合适的是
A.用冷水洗 B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗 D.用90%的乙醇溶液洗
②为了测定产品的纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c molL﹣1的酸性KMnO4溶液滴定.每次所取待测液体积均为25.00mL,实验结果记录如表:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
KMnO4溶液应盛装在滴定管中,滴定过程中发生反应的离子方程式为滴定终点的现象是通过实验数据计算的该产品纯度为(用字母ac表示).上表中第一次实验中记录数据明显大于后两次,其原因可能是
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低.