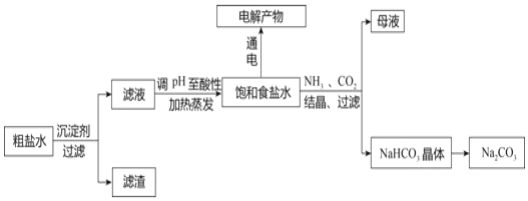
题目内容
【题目】X、Y、Z、W为原子序数依次增大的四种短周期主族元素,X原子的最外层电子数是其内层电子数的2倍,W+与Y2-具有相同的电子层结构。下列说法正确的是
A.Y与氢元素所形成的化合物分子中只含有极性键
B.W2Y、W2Y2中阴、阳离子个数比均为1∶2
C.Z的最高价氧化物对应的水化物的酸性比X的强
D.将XY2通入W单质与水反应后的溶液中,生成的盐只有一种
【答案】B
【解析】
X原子的最外层电子数是其内层电子数的2倍,则X为C;W+与Y2-具有相同的电子层结构,则W为Na,Y为O;这四种元素均为主族元素,且原子序数依次增大,则Z为F。
A、O与H形成的化合物有H2O、H2O2,H2O中只含有极性键,H2O2中既含有极性键又含有非极性键,故A错误;
B、Na2O中离子为Na+、O2-,Na2O2中离子为Na+、O22-,二者阴、阳离子个数比均为1∶2,故B正确;
C、F无正价,也无最高价氧化物对应的水化物,故C错误;
D、Na与水反应后的溶液为NaOH溶液,将CO2通入NaOH溶液中,当![]() ≤
≤![]() 时,生成的盐只有Na2CO3,当
时,生成的盐只有Na2CO3,当![]() <
<![]() <1时,生成的盐有Na2CO3和NaHCO3,当
<1时,生成的盐有Na2CO3和NaHCO3,当![]() ≥1时,生成的盐只有NaHCO3,故D错误;
≥1时,生成的盐只有NaHCO3,故D错误;
答案选B。

【题目】在恒温、恒容条件下发生下列反应:2X2O5 (g) ![]() 4XO2(g) +O2(g) △H>0,T温度下的部分实验数据为:
4XO2(g) +O2(g) △H>0,T温度下的部分实验数据为:
t/s | 0 | 50 | 100 | 150 |
c(X2O5) mol/L | 4.00 | 2.50 | 2.00 | 2.00 |
下列说法错误的是
A. T温度下的平衡数为K=64 (mol/L)3,100s时转化率为50%
B. 50s 内 X2O5分解速率为 0.03 mol/ (Ls)
C. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则Kl>K2
D. 若只将恒容改为恒压,其它条件都不变,则平衡时X2O5的转化率和平衡常数都不变
【题目】苯甲酸乙酯是重要的精细化工试剂,常用于配制水果型食用香精。实验室制备流程如下:
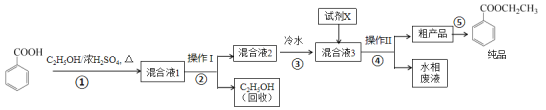
试剂相关性质如下表:
苯甲酸 | 乙醇 | 苯甲酸乙酯 | |
常温性状 | 白色针状晶体 | 无色液体 | 无色透明液体 |
沸点/℃ | 249.0 | 78.0 | 212.6 |
相对分子量 | 122 | 46 | 150 |
溶解性 | 微溶于水,易溶于乙醇、乙醚等有机溶剂 | 与水任意比互溶 | 难溶于冷水,微溶于热水,易溶于乙醇和乙醚 |
回答下列问题:
(1)为提高原料苯甲酸的纯度,可采用的纯化方法为_________。
(2)步骤①的装置如图所示(加热和夹持装置已略去),将一小团棉花放入仪器B中靠近活塞孔处,将吸水剂(无水硫酸铜的乙醇饱和溶液)放入仪器B中,在仪器C中加入 12.2 g纯化后的苯甲酸晶体,30 mL无水乙醇(约0.5 mol)和3 mL浓硫酸,加入沸石,加热至微沸,回流反应1.5~2 h。仪器A的作用是_________;仪器C中反应液应采用_________方式加热。
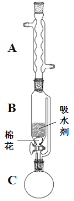
(3)随着反应进行,反应体系中水分不断被有效分离,仪器B中吸水剂的现象为_________。
(4)反应结束后,对C中混合液进行分离提纯,操作I是_________;操作II所用的玻璃仪器除了烧杯外还有_________。
(5)反应结束后,步骤③中将反应液倒入冷水的目的除了溶解乙醇外,还有_____;加入试剂X为_____(填写化学式)。
(6)最终得到产物纯品12.0 g,实验产率为_________ %(保留三位有效数字)。