题目内容
【题目】25℃时,下列有关溶液中微粒的物质的量浓度关系不正确的是
A.0.1 mol·L-1 CH3COONa溶液与0.1 mol·L-1 HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-)
B.等体积、等物质的量浓度的NaX和弱酸HX混合后呈酸性的溶液中:c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-)
C.0.1 mol·L-1 Na2CO3溶液与0.1 mol·L-1 NaHCO3溶液等体积混合:3c(Na+)=2c(![]() )+2c(
)+2c(![]() )+2c(H2CO3)
)+2c(H2CO3)
D.0.1 mol·L-1 Na2C2O4溶液与0.1 mol·L-1 HCl溶液等体积混合(H2C2O4为二元弱酸):2c(![]() )+c(
)+c(![]() )+c(OH-)=c(Na+)+c(H+)
)+c(OH-)=c(Na+)+c(H+)
【答案】CD
【解析】
A.0.1 mol·L-1CH3COONa溶液与0.1 mol·L-1HCl溶液等体积混合所得溶液的溶质可以认为等物质的量的NaCl和CH3COOH,所以c(Na+)=c(Cl-),而醋酸为弱酸,难电离,所以c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-),故A正确;
B.等体积、等物质的量浓度的NaX和弱酸HX混合后溶液显酸性,所以HX的电离程度大于X-的水解程度,所以c(X-)>c(HX),而根据物料守恒可知2c(Na+)= c(X-)+c(HX),所以c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-),故B正确;
C.0.1molL-1Na2CO3溶液与0.1molL-1NaHCO3溶液等体积混合,由物料守恒可知2n(Na)=3n(C),所以2c(Na+)=3c(![]() )+3c(
)+3c(![]() )+3c(H2CO3),故C错误;
)+3c(H2CO3),故C错误;
D.0.1molL-1Na2C2O4溶液与0.1molL-1HCl溶液等体积混合,由电荷守恒可知2c(![]() )+c(
)+c(![]() )+c(OH-)+ c(Cl-)=c(Na+)+c(H+),故D错误;
)+c(OH-)+ c(Cl-)=c(Na+)+c(H+),故D错误;
故答案为CD。

 全能测控一本好卷系列答案
全能测控一本好卷系列答案 发散思维新课堂系列答案
发散思维新课堂系列答案【题目】利用实验器材(规格和数量不限,省略夹持装置),能够完成相应实验的有几项( )
实验器材 | 相应实验 | |
① | 量筒、温度计、烧杯、碎纸条、盖板 | 中和热的测定 |
② | 烧杯、分液漏斗 | 用饱和Na2CO3溶液除去乙酸乙酯中的乙酸和乙醇 |
③ | 量筒、玻璃捧、烧杯、100mL容量瓶 | 用浓盐酸配制100mL0.1molL-1的稀盐酸溶液 |
④ | 烧杯、酸式滴定管、碱式滴定管、锥形瓶 | 用H2SO4标准液滴定未知浓度的NaOH溶液 |
⑤ | 蒸馏烧瓶、酒精灯、温度计、直形冷凝管、锥形瓶、牛角管、石棉网 | 分离甲醇和甘油的混合物 |
⑥ | 坩埚、酒精灯、玻璃棒、泥三角、三脚架 | 从食盐水中得到NaCl晶体 |
A.2项B.3项C.4项D.5项
【题目】苯甲酸乙酯是重要的精细化工试剂,常用于配制水果型食用香精。实验室制备流程如下:
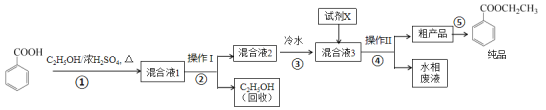
试剂相关性质如下表:
苯甲酸 | 乙醇 | 苯甲酸乙酯 | |
常温性状 | 白色针状晶体 | 无色液体 | 无色透明液体 |
沸点/℃ | 249.0 | 78.0 | 212.6 |
相对分子量 | 122 | 46 | 150 |
溶解性 | 微溶于水,易溶于乙醇、乙醚等有机溶剂 | 与水任意比互溶 | 难溶于冷水,微溶于热水,易溶于乙醇和乙醚 |
回答下列问题:
(1)为提高原料苯甲酸的纯度,可采用的纯化方法为_________。
(2)步骤①的装置如图所示(加热和夹持装置已略去),将一小团棉花放入仪器B中靠近活塞孔处,将吸水剂(无水硫酸铜的乙醇饱和溶液)放入仪器B中,在仪器C中加入 12.2 g纯化后的苯甲酸晶体,30 mL无水乙醇(约0.5 mol)和3 mL浓硫酸,加入沸石,加热至微沸,回流反应1.5~2 h。仪器A的作用是_________;仪器C中反应液应采用_________方式加热。
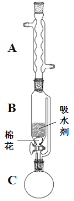
(3)随着反应进行,反应体系中水分不断被有效分离,仪器B中吸水剂的现象为_________。
(4)反应结束后,对C中混合液进行分离提纯,操作I是_________;操作II所用的玻璃仪器除了烧杯外还有_________。
(5)反应结束后,步骤③中将反应液倒入冷水的目的除了溶解乙醇外,还有_____;加入试剂X为_____(填写化学式)。
(6)最终得到产物纯品12.0 g,实验产率为_________ %(保留三位有效数字)。