题目内容
3.下列叙述中正确的是( )①同周期元素中,ⅦA族元素的原子半径最大
②ⅥA族元素的原子,其半径越大,越容易得到电子
③同一周期中,碱金属元素的第一电离能最小
④当各轨道处于全满、半满、全空时原子较稳定.
| A. | ①② | B. | ②④ | C. | ①③ | D. | ③④ |
分析 ①同周期元素(稀有气体除外)中,从左至右原子半径依次减小;
②ⅥA族元素的原子,其半径越大,越不容易得电子;
③越易失去一个电子,则第一电离能越小;
④轨道处于全满,半满,全空时原子不易得失电子,为稳定结构.
解答 解:①同周期元素(稀有气体除外)中,从左至右原子半径依次减小,所以,ⅦA族元素的原子半径最小,故A错误;
②ⅥA族元素的原子,其半径越大,原子核对外层电子的吸引能力越弱,越不容易得电子,故错误;
③越易失去一个电子,则第一电离能越小,同一周期中,碱金属元素最易失去一个电子,所以其第一电离能最小,故正确;
④由电子排布及能量最低原理可知,轨道处于全满,半满,全空时原子不易得失电子,能量低为稳定结构,故正确;
故选D.
点评 本题考查了元素结构与性质,注意把握元素在周期表中的位置及元素周期律即可解答,题目难度大.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
13.常温下,下列各溶液中,酸性最强的是( )
| A. | pH=3 | B. | c(H+)=5×10-5mol/L | ||
| C. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=6 | D. | c(OH-)=10-12mol/L的溶液 |
14.如表是不同温度下水的离子积数据:
若25<t1<t2,则α>(填“<”“>”或“=”)1×10-14.
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
11.X、Y、Z是原子序数依次递增的短周期元素,3种元素的原子核外电子数之和与Ca2+的核外电子数相等,X、Z分别得到一个电子后均形成稀有气体原子的稳定电子层结构.下列说法正确的是( )
| A. | 非金属性:Y>Z | |
| B. | Z与X形成化合物的沸点高于Z的同族元素与X形成化合物的沸点 | |
| C. | CaY2与水发生氧化还原反应时,CaY2只作氧化剂 | |
| D. | CaX2、CaY2和CaZ2等3种化合物中,阳离子与阴离子个数比均为1:2 |
8.下列描述中正确的是( )
| A. | CS2为直线形的极性分子 | |
| B. | CH4中键能、键长和键角均相同 | |
| C. | AB2为V形,则A一定为sp2杂化 | |
| D. | SiF4和SO32-的中心原子均为sp2杂化 |
12.下列方程式表示的反应既不属于加成反应也不属于取代反应的是( )
| A. | C6H5CH2Cl+NaCN→C6H5CH2CN+NaCl | |
| B. | C6H5Li+CO2→C6H5COOLi | |
| C. | CH3CH2CHO+HCN$\stackrel{NaOH}{→}$ | |
| D. | CH3COOCH2CH3$→_{气相}^{450℃}$CH3COOH+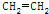 |
13.下列说法不正确的是( )
| A. | 温度升高,正、逆反应速率都增大 | |
| B. | 化学反应的速率和限度均可通过改变化学反应条件而改变 | |
| C. | 氢气和氧气化合生成水和水的电解是可逆反应 | |
| D. | 化学反应达到平衡状态时,正反应速率与逆反应速率相等 |