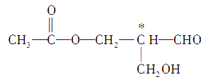题目内容
【题目】下图为某市售盐酸试剂瓶标签上的部分数据。请通过计算回答:

(1)此盐酸的物质的量的浓度为多少?__________
(2)该盐酸50mL与2.5 mol·L-1的NaOH溶液200mL混合,再将混合后溶液稀释至900mL,此时溶液中氢离子的物质的量浓度约为多少?_____________
(3)在标准状况下,1体积水吸收多少体积的HCl气体可制得此盐酸?(保留一位小数,水的密度以1.00g/cm3计)_____________
【答案】11.8mol·L-1 0.1 mol·L-1 352.8 L
【解析】
(1)此盐酸的物质的量的浓度c=![]() =1000×1.18×36.5%/36.5=11.8mol·L-1 ;综上所述,本题答案是:11.8mol·L-1。
=1000×1.18×36.5%/36.5=11.8mol·L-1 ;综上所述,本题答案是:11.8mol·L-1。
2)50mL11.8mol·L-1盐酸的物质的量为0.59mol;2.5 mol·L-1的NaOH溶液200mL,物质的量为0.5mol;酸碱发生中和,剩余盐酸的量=0.59-0.5=0.09mol;稀释后溶液体积为900mL,所以反应后溶液中盐酸的浓度为0.09/0.9=0.1 mol·L-1;此时溶液中氢离子的物质的量浓度约为0.1 mol·L-1;综上所述,本题答案是:0.1 mol·L-1。
(3)在标准状况下,设1L水吸收VL的HCl气体可制得此盐酸,质量分数=m(溶质)/m(溶液)×100%=(36.5V/22.4)/( 36.5V/22.4+1000×1)×100%=36.5%,计算得到V=352.76L≈352.8 L;综上所述,本题答案是:352.8 L。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
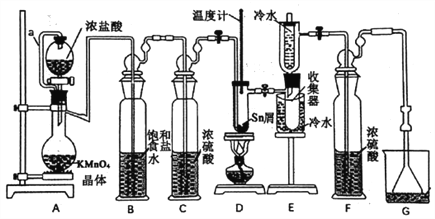
小学生10分钟应用题系列答案【题目】无水四氯化锡(SnCl4)常用作有机合成的氯化催化剂。实验室可用熔融的锡(熔点231.9℃)与Cl2反应制备SnCl4,装置如下图所示。
已知:①SnCl2、SnCl4有关物理性质如下表
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 652 |
SnCl4 | 无色液体 | -33 | 114 |
②SnCl4在空气中极易水解生成SnO2·xH2O。
回答下列问题:
(1)导管a的作用是____________,装置A中发生反应的离子方程式为___________。
(2)当观察到装置F液面上方出现___________现象时才开始点燃酒精灯,待锡熔化后适当增大氯气流量,继续加热。此时继续加热的目的是___________、___________。
(3)若上述装置中缺少装置C(其它均相同),则D处具支试管中发生的主要副反应化学方程式为___________ 。
(4)若制得产品中含有少量Cl2,则可采用下列___________(填字母)措施加以除去。
A.加入NaOH萃取分液 B.加入足量锡再加热蒸馏
C.加入碘化钾冷凝过滤 D.加入饱和食盐水萃取
(5)可用碘量法测定最后产品的纯度,发生如下反应:Sn2++I2=Sn4++2Iˉ。准确称取该样品m g放于锥形瓶中,用少量浓盐酸溶解,再加水稀释,淀粉溶液作指示剂,用0.1mol·L-1碘标准溶液滴定至终点,消耗标准液20.00mL,则产品中SnCl2的含量为___________(用含m的代数式表示);即使此法测定的操作均正确,但测得的SnCl4含量仍高于实际含量,其原因可能是___________(用离子方程式表示)。