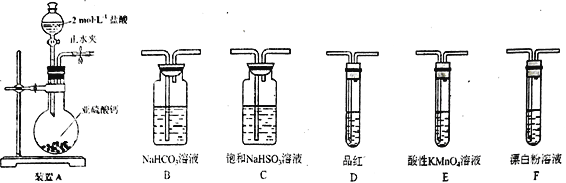
题目内容
【题目】(1)0.5 mol SO2共约含有_____个原子,它与______gSO3所含硫原子数相等。
(2)3.6gNH4+共约含有_____个电子,共约含有_____个中子
(3)质量相同的 ①HCl、②NH3、③CO2、④O2四种气体中,含有分子数目最少的是(填序号)___________________。
(4)有100mL 0.2 mol/L 的NaOH溶液,将此溶液稀释到200 mL,则溶液中Na+的物质的量是__________ 。将稀释后的溶液与300 mL 0.4 mol/L 的NaOH溶液混合后,Na+的物质的量浓度是__________ 。
【答案】1.5NA402NA1.4NA③0.020.28
【解析】
(1)0.5 mol SO2中含有原子的物质的量是0.5mol×3=1.5mol,共含有1.5NA个原子,分子中含有0.5mol硫原子,则含有相同硫原子的三氧化硫的物质的量是0.5mol,其质量是0.5mol×80g/mol=40g。
(2)3.6gNH4+的物质的量是3.6g÷18g/mol=0.2mol,1个铵根含有10个电子、7个中子,则共含有2NA个电子、1.4NA个中子
(3)根据N=m/MNA可知质量相同时气体的摩尔质量越大,分子数目越少。①HCl、②NH3、③CO2、④O2四种气体的摩尔质量分别是(mol/L)36.5、17、44、32,所以含有分子数目最少的是二氧化碳,答案选③。
(4)有100mL 0.2 mol/L的NaOH溶液,将此溶液稀释到200 mL,则根据稀释过程中溶质的物质的量不变可知稀释后溶液中Na+的物质的量是0.1L×0.2mol/L=0.02mol。将稀释后的溶液与300 mL 0.4 mol/L的NaOH溶液混合后,Na+的物质的量浓度是![]() 。
。

 阅读快车系列答案
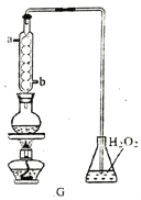
阅读快车系列答案【题目】某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照以下方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2%H2O2溶液 | 无 |
② | 10 mL 5% H2O2溶液 | 无 |
③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
(1)实验①和②的目的是______________________。
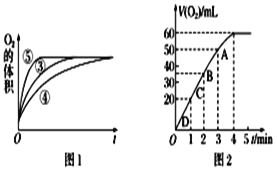
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图1。分析图1能够得出的实验结论是(Ⅰ)____________。(Ⅱ)_____________。
(3)加入0.1 g MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图2所示。反应速率逐渐变化的原因是________________。
【题目】CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿[主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等]制取CoCl2·6H2O的工艺流程如下:
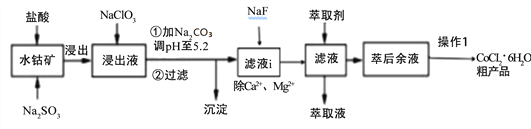
已知:①浸出液含有的阳离子主要有H+、Co2+、Ca2+、Mg2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl26H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方式_______________________________。
(2)NaClO3的作用是____________________写出该反应的离子方程式_____________;
若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体是 ___________(填化学式)。
(3)加Na2CO3调pH至5.2所得沉淀为________________。
(4)萃取剂对金属离子的萃取率与pH的关系如下图。加萃取剂的目的是_______________;其使用的最佳pH范围是(填字母代号)__________。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
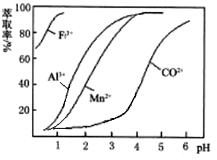
(5)操作I包含3个基本实验操作是蒸发、结晶和过滤.制得的CoCl26H2O需减压烘干的原因是______________________________。
(6)除“钙”“镁”是将滤液i中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知某温度下,Ksp(MgF2)=7.35×10-11,Ksp(CaF2)=1.50×10-10。当加入过量NaF,所得滤液中c(Mg2+)/c(Ca2+)=_____________。