题目内容
【题目】镁及其化合物有着广泛用途。工业上以菱镁矿(主要成分为MgCO3,含SiO2以及少量FeCO3等杂质)为原料制备纳米氧化镁的实验流程如下:
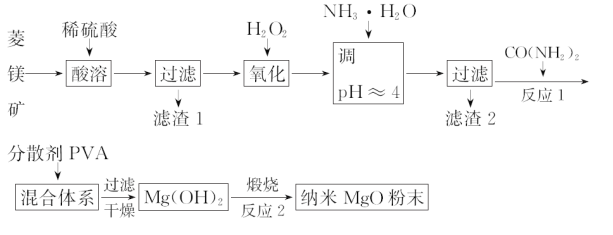
(1)滤渣1为______________________。
(2)加入H2O2氧化时,发生反应的离子方程式为______________________。
(3)在实验室煅烧滤渣2制得的金属氧化物为____________(填化学式),需要的仪器除酒精灯、三脚架、泥三角以外,还需要______________(填名称)。
(4)在一定条件下CO(NH2)2可与H2O反应生成CO2和一种弱碱,该反应中反应物的质量之比为________。
(5)25℃时,加入CO(NH2)2至开始产生沉淀,当Mg2+全部沉淀时溶液的c(OH-)=__________(已知25℃,Ksp[Mg(OH)2]=1.96×10-11)。
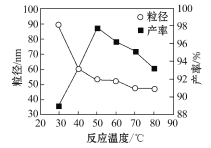
(6)工业上还可用氯化镁和碳酸铵为原料,采用直接沉淀法制备 纳米MgO。取少量制得的该物质溶于某种液体溶剂中(两者不反应),能说明是纳米MgO存在的简单方法是____________。如图为反应温度对纳米MgO产率和粒径的影响,据图分析反应的最佳温度为____________。
【答案】(1)SiO2;(2)2Fe2++H2O2+2H+=2Fe3++2H2O;(3)Fe2O3,坩埚;
(4)10∶9(或9∶10);(5)1.4×10-3mol·L-1;
(6)用一束光照射,在侧面会看到一条光亮的通路(或答丁达尔现象);50℃。
【解析】
试题分析:(1)根据菱镁矿的成分,MgCO3和FeCO3和稀硫酸反应,SiO2是酸性氧化物,不与稀硫酸反应,因此滤渣1是SiO2;(2)加入过氧化氢的目的,是把Fe2+氧化成Fe3+,离子反应方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;(3)调节pH=4,使Fe3+全部以Fe(OH)3形式沉降出来,因此煅烧Fe(OH)3,得到产物是Fe2O3,煅烧时用到仪器是坩埚;(4)反应方程式为CO(NH2)2+3H2O=CO2+2NH3·H2O,反应物的质量比=60:54=10:9;(5)根据Ksp=c(Mg2+)×c2(OH-),代入数值,c(Mg2+)=1×10-5mol·L-1,c(OH-)=1.4×10-3mol·L-1;(6)纳米分散系属于胶体,验证胶体常用丁达尔效应;根据图,最佳温度是50℃,产率最高,因此选择50℃。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案