��Ŀ����
����Ŀ�������£��� 0��01 mol��L��1NaOH��Һ�ζ� 20��00 mL 0��01 mol��L��1CH3COOH��Һ�����õζ�������ͼ������˵����ȷ����
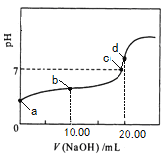
A. a���Ӧ��Һ��pH=2
B. b���Ӧ����Һ�У�c(OH��)+ c(CH3COO��) = c(Na+)+ c(H+)
C. c���ʾNaOH��Һ��CH3COOH��Һǡ����ȫ��Ӧ
D. d���Ӧ����Һ�У�ˮ�ĵ���̶�С��ͬ���´�ˮ�ĵ���̶�
���𰸡�B
��������
�������Ϊ���ᣬ������ȫ���룬��0��01mol?L-1 CH3COOH��ҺpH��2����A������Һ�д��ڵ���غ㣺c��Na����+c��H����=c��OH����+c��CH3COO��������B��ȷ��������������Ʒ�Ӧ���ɴ����ƣ���������ǿ����������ˮ��Һ�ʼ��ԣ������ǡ�÷�Ӧʱ��ҺӦ�óʼ��ԣ���C����Һ�����ԣ�˵�����������C����d��ʱ��Һ�ʼ��ԣ������ǡ���кͣ���ȫ��Ӧ���ɴ����ƣ�ˮ��ʼ��ԣ��ٽ�ˮ�ĵ��룬��D����ѡB��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ��ij�¶��£���һ�ܱ������г���һ����CO2���������������ۣ�������Ӧ��Fe(s)��CO2(g) ![]() FeO(s)��CO(g)�����CO2��COŨ����ʱ��ı仯��ͼ��ʾ��
FeO(s)��CO(g)�����CO2��COŨ����ʱ��ı仯��ͼ��ʾ��

��1��0��8 min��v(CO2)��__________mol��L��1��min��1��
��2���÷�Ӧ�ں��º��ݵ��ܱ������н��У���˵���÷�Ӧ�ﵽ��ѧƽ��״̬����_____
A����λʱ���� ��ÿ����1molCO2ͬʱ����1molCO
B�������������ѹǿ������ʱ��仯
C��������������ܶȲ�����ʱ��仯
D�������������ƽ����Է�������������ʱ��仯
��3��������¶��£���ӦFe(s)��CO2(g) ![]() FeO(s)��CO(g)��ƽ�ⳣ��__________
FeO(s)��CO(g)��ƽ�ⳣ��__________
��4�����д�ʩ�У��ܹ��ı�ƽ��ʱc(CO)/c(CO2)�ı�ֵ����________(�����)��
A���¶� B�����۵���(����) C��ѹǿ D��CO����
��5����֪����ӦFe(s)��CO2(g) ![]() FeO(s)��CO(g)��ƽ�ⳣ��ΪK1����ӦFe(s)��H2O(g)
FeO(s)��CO(g)��ƽ�ⳣ��ΪK1����ӦFe(s)��H2O(g) ![]() FeO(s)��H2(g)��ƽ�ⳣ��ΪK2����ͬ�¶�ʱK1��K2��ֵ���±���
FeO(s)��H2(g)��ƽ�ⳣ��ΪK2����ͬ�¶�ʱK1��K2��ֵ���±���
�¶�/K | K1 | K2 |
973 | 1.47 | 2.38 |
1 173 | 2.15 | 1.67 |
�ٷ�ӦFe(s)��H2O(g) ![]() FeO(s)��H2(g)Ϊ______(����ȡ����ȡ�)��Ӧ
FeO(s)��H2(g)Ϊ______(����ȡ����ȡ�)��Ӧ
�ڸ��ݱ������ݣ����㷴ӦCO2(g)��H2(g) ![]() CO(g)��H2O(g) 973 K��K______��д������ʽ���ɣ����ؼ���������
CO(g)��H2O(g) 973 K��K______��д������ʽ���ɣ����ؼ���������
����Ŀ���±���Ԫ�����ڱ����һ���֣����������Ԫ���Լ���Ӧ�������ش��й����⣺
���� ���� | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
1 | �� | ||||||
2 | �� | �� | �� | �� | |||
3 | �� | �� | �� | �� | |||
4 | �� |
��1��д���ɢٺ͢�����Ԫ����ɵIJ�������������ʵĻ�ѧʽ��________��_______��
��2����~���Ԫ��������������Ӧ��ˮ����������ǿ����Ļ�ѧʽΪ��_______��
��3���������������Ӧ��ˮ������������������ڼ��ȵ������������κ�ˮ�Ļ�ѧ����ʽΪ��___________________________________________________________��
��4�����ݵĵ���ͨ��ܵij����⻯���У���Ӧ���ң���Ӧ�Ļ�ѧ����ʽΪ��________��
��5����ͬ�����¢ݢޢߢ�����Ԫ�ص�ԭ�Ӱ뾶�ɴ�С��˳���ǣ�________________��