题目内容
几种短周期元素的原子半径及主要化合价如下表
| 元素代号 | L | M | X | R | T |
| 原子半径(nm) | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
下列说法正确的是
A.L、T形成的简单离子核外电子数相等
B.R的氧化物对应的水化物呈强碱性
C.X单质在氧气中燃烧生成XO3
D.离子半径大小:r(M3+)> r(T2-)
A
解析试题分析:L和R的化合价都为+2价,应为周期表第ⅡA族,根据半径关系可知R为Be,L为Mg,X和T的化合价都有-2价,应为周期表第ⅥA族元素,X的最高价为+6价,应为S元素,T无正价,应为O元素,M的化合价为+3价,应为周期表第ⅢA族元素,根据半径大于R小于L可知应和L同周期,为Al元素,则A、Mg2+核外有2个电子层,O2-核外有2个电子层,二者电子层结构相同,故A正确;B、R为Be,与Al位于周期表对角线位置,性质相似,Al的氧化物的水化物为两性氢氧化物,则Be的氧化物对应的水化物可能具有两性,故B不正确;C、S在空气中燃烧只生成SO2,二氧化硫与氧气在催化剂的条件下反应生成SO3,故C不正确;D、Al3+和O2-具有相同的核外电子排布,原子序数越大,半径越小,则离子半径大小:r(Al3+)<r(O2-),故D错误,故选A。
考点:考查元素位置结构和性质的关系及应用

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案下图是周期表中短周期的一部分,A、C的原子序数之和等于B原子的原子序数。下列叙述正确的是
| A | | C |
| | B | |
A.B的氧化物对应的水化物一定为强酸,且只有氧化性
B.三种元素对应的氢化物中C的氢化物稳定性最好
C.原子半径大小关系为:C>A
D.C的单质常温下为无色无味的气体
X、Y、Z、W为四种短周期元素,它们在周期表中的位置如图所示。Z元素原子核外第一层与第三层电子数相等。下列说法不正确的是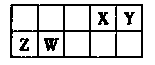
| A.与相同浓度的盐酸反应,Z单质比W单质更剧烈 |
| B.Y元素可以形成多种具有漂白性的化合物 |
| C.Y与Z、Y与W形成的化合物含有的化学键类型相同 |
| D.四种元素的离子半径大小为Z>W>X>Y |
短周期主族元素X、Y、Z、W 的原子序数依次增大, X、Y、Z原子序数之和是W的2倍,X、Z在周期表中的相对位置如图所示,X的最低负价绝对值与其原子最外层电子数相等。下列说法正确的是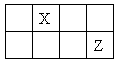
| A.原子半径: r(Y)> r (Z)> r (W) |
| B.Y、Z、W的简单离子的电子层结构相同 |
| C.XWm与YWn中化学键类型相同(m、n为正整数) |
| D.元素Z 的简单气态氢化物的热稳定性比W 的强 |
下列排列顺序正确的是
①热稳定性:H2O>HF>H2S
②原子半径:Na>Mg>F
③酸性:H3PO4>H2SO4>HClO4
④失电子能力:Na>Mg>Al
⑤晶体的熔点:SiO2>NaCl>CCl4>SO2
| A.②④⑤ | B.①②④ | C.②③⑤ | D.全部正确 |
短周期元素X、Y、W、Q在元素周期表中的相对位置如图所示.常温下,Al能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液.下列说法正确的是( )
| A.Y的最高化合价为+6 |
| B.离子半径:W>Q>Y>X |
| C.氢化物的沸点:Y>Q |
| D.最高价氧化物的水化物的酸性:W>Q |
主族元素M、R形成的简单离子M2-离子与R+离子的核外电子数之和为20,下列说法正确的是
| A.M原子的质子数一定大于R原子的质子数 |
| B.M可能存在16M、18M两种核素 |
| C.M2-的离子与R+的电子层结构不可能相同 |
| D.两种离子结合形成的化合物中可能含有共价键 |
如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素。下列关于这四种元素及其化合物的说法中正确的是( ) 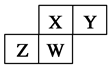
| A.原子半径:W>Z>Y>X |
| B.气态氢化物的稳定性:Z>W>X>Y |
| C.W的最高正化合价与负化合价的绝对值可能相等 |
| D.Z的最高价氧化物的水化物可能为强碱 |
