题目内容
X、Y、Z、W为四种短周期元素,它们在周期表中的位置如图所示。Z元素原子核外第一层与第三层电子数相等。下列说法不正确的是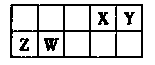
| A.与相同浓度的盐酸反应,Z单质比W单质更剧烈 |
| B.Y元素可以形成多种具有漂白性的化合物 |
| C.Y与Z、Y与W形成的化合物含有的化学键类型相同 |
| D.四种元素的离子半径大小为Z>W>X>Y |
D
解析试题分析:根据常见元素在周期表中的位置及元素周期表的结构知,X、Y位于第二周期,Z、W位于第三周期,Z元素原子核外第一层与第三层电子数相等,则Z为镁元素,W为铝元素,X为氮元素,Y为氧元素。A、镁比铝活泼,与相同浓度的盐酸反应,镁单质比铝单质更剧烈,正确; B、氧元素可以形成过氧化氢、次氯酸、二氧化硫等多种具有漂白性的化合物,正确;C、氧化镁和氧化铝中的化学键均为离子键,化学键类型相同,正确;D、电子层结构相同的微粒,核电荷数越大离子越小,四种元素的离子半径大小为X>Y>Z>W,错误。
考点:考查元素推断、元素周期律及相关物质的结构与性质。

练习册系列答案
相关题目
已知质量数为A的某阴离子Rn-,核外有x个电子,则核内中子数为( )
| A.A- x |
| B.A-x-n |
| C.A-x+n |
| D.A+x-n |
国外科学家曾将铅(Pb)和氪(Kr)两种元素的原子核对撞,获得了一种质子数为118、
质量数为293的新元素,该元素原子核内的中子数和核外电子数之差为
| A.47 | B.57 | C.61 | D.175 |
下列各基态原子或离子的电子排布式正确的是
| A.O2-1s22s22p4 | B.Ca [Ar]3d2 |
| C.Fe [Ar]3d54s3 | D.Si 1s22s22p63s23p2 |
a、b、c、d、e为元素周期表前3周期中的部分元素,它们在元素周期表中的相对位置如图所示。下列叙述正确的是( )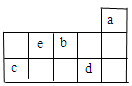
| A.b元素除0价外,只有一种化合价 |
| B.五种元素中,c元素的单质性质最稳定 |
| C.d气态氢化物的水溶液既有氧化性也有还原性 |
| D.e元素最高价氧化物对应的水化物是一种强酸,保存在无色试剂瓶里 |
几种短周期元素的原子半径及主要化合价如下表
| 元素代号 | L | M | X | R | T |
| 原子半径(nm) | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
下列说法正确的是
A.L、T形成的简单离子核外电子数相等
B.R的氧化物对应的水化物呈强碱性
C.X单质在氧气中燃烧生成XO3
D.离子半径大小:r(M3+)> r(T2-)
下列说法正确的是
| A.短周期元素形成离子后,最外层均达8电子稳定结构 |
| B.多电子原子中,在离核较近的区域运动的电子能量较低 |
| C.非金属元素组成的化合物中只有共价键 |
| D.HF、HCl、HBr、HI的热稳定性和还原性依次增强 |
以下有关原子结构及元素周期律的叙述正确的是
| A.第IA族元素铯的两种同位素137Cs比133Cs多4个质子 |
| B.同周期元素(除0族元素外)从左到右,原子半径逐渐减小 |
| C.第ⅦA元素从上到下,其氢化物的稳定性逐渐增强 |
| D.同主族元素从上到下,单质的熔点逐渐降低 |