题目内容
19.氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于区域3的( )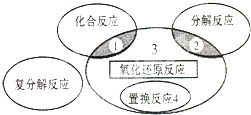
| A. | 4Fe(0H)2+O2+2H2O═4Fe(OH)3 | B. | 2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2 O+CO2↑ | ||
| C. | 4NH3+5O2 $\frac{\underline{催化剂}}{△}$4NO+6H2O | D. | Zn+H2SO4═ZnSO4+H2↑ |
分析 由图可知,区域3属于氧化还原反应,但不属于置换反应、化合反应和分解反应,有元素化合价变化的反应为氧化还原反应,单质与化合物反应生成单质与化合物的反应为置换反应,两种或两种以上的物质生成一种物质为化合反应,一种物质生成多种物质的为分解反应,以此来解答.
解答 解:A、属于化合反应,且元素的化合价没有变化,不属于氧化还原反应,故A不选;
B、属于分解反应,且元素的化合价没有变化,不属于氧化还原反应,故B不选;
C、氮元素的化合价升高,氧元素的化合价降低,为氧化还原反应,且不是分解反应、化合反应和置换反应,故C选;
D、属于置换反应,也属于氧化还原反应,故D不选;
故选C.
点评 本题考查氧化还原反应及四种基本反应类型,明确反应的分类及反应中元素的化合价变化是解答本题的关键,题目难度不大.

练习册系列答案
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
9.下列叙述正确的是( )
| A. | CH2Cl2有 和 和 两种结构 两种结构 | |
| B. | 烯烃跟氢气起加成反应产物是2,2,3,4-四甲基戊烷,则这样的烯烃有3种 | |
| C. | 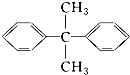 的一氯代物有5种 的一氯代物有5种 | |
| D. | 1 mol某烷烃完全燃烧消耗11 mol O2,则其主链上含有5个碳原子的同分异构体(不考虑空间异构)有6种 |
10.三氟化氮(NF3)气体在潮湿的环境中能发生如下反应:3NF3+5H20=2N0+HNO3+9HF.下列有关该反应的说法正确的是( )
| A. | NF既是氧化剂,又还原剂 | |
| B. | 还原剂与氧化剂的物质的量之比为1:2 | |
| C. | 若生成2molHNO3,则转移2mol电子 | |
| D. | NF3中氢元素的化合价为+3 |
7.某中学化学兴趣小组为了测定某矿山石灰石中碳酸钙的质量分数,取石灰石样品与足量的10%的稀盐酸在烧杯中反应(假设石灰石样品中杂质不与稀盐酸反应也不溶于水).有关实验数据如下表:
请计算(写出计算过程):
(1)该石灰石中碳酸钙的质量分数;
(2)参加反应10%的盐酸的质量.
| 反应前 | 反应后 | ||
| 实验 数据 | 烧杯和稀盐酸的质量 | 石灰石样品的质量 | 烧杯和其中混合物的质量 |
| 134.4g | 10g | 141.1g | |
(1)该石灰石中碳酸钙的质量分数;
(2)参加反应10%的盐酸的质量.
14.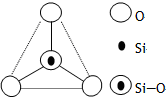 如图所示某硅氧离子的空间结构示意图(虚线不表示共价键).通过观察分析,下列叙述正确的是( )
如图所示某硅氧离子的空间结构示意图(虚线不表示共价键).通过观察分析,下列叙述正确的是( )
 如图所示某硅氧离子的空间结构示意图(虚线不表示共价键).通过观察分析,下列叙述正确的是( )
如图所示某硅氧离子的空间结构示意图(虚线不表示共价键).通过观察分析,下列叙述正确的是( )| A. | 键角为120℃ | B. | 化学组成为SiO32- | ||
| C. | 键角为60° | D. | 化学组成为SiO44- |
8.下列有关说法中,不正确的是( )
| A. | 维勒用无机物合成了尿素,突破了无机物和有机物的界限 | |
| B. | 石油裂解的目的是提高汽油等轻质油的产量和质量 | |
| C. | 羟基不带电,氢氧根带一个单位负电荷,氢氧根比羟基稳定 | |
| D. | 苯分子中不存在单双键交替的事实是苯的邻二取代物没有同分异构体 |
9.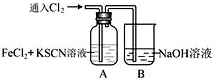 Ⅰ.甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究.向A中通入氯气至过量,观察A中,发现溶液先呈红色,然后变为黄色.
Ⅰ.甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究.向A中通入氯气至过量,观察A中,发现溶液先呈红色,然后变为黄色.
(1)B中反应的离子方程式是Cl2+2OH-═Cl-+ClO-+H2O;
(2)为了探究A中溶液由红色变为黄色的原因,甲同学进行如下实验.取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在Fe3+;
(3)资料显示:SCN -的电子式为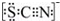 .甲同学猜想SCN-可能被Cl2氧化了,他进行了如下研究;
.甲同学猜想SCN-可能被Cl2氧化了,他进行了如下研究;
①取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明
SCN-中被氧化的元素是硫元素;
②甲同学通过实验证明了SCN-中氮元素转化为NO3-,已知SCN-中碳元素没有被氧化,若SCN-与Cl2反应生成1mol CO2,则转移电子的物质的量是16mol;
Ⅱ.8.12天津港特大爆炸事故现场有700吨左右氰化钠,氰化钠剧毒.有少量因爆炸冲击发生泄漏.这些泄露的氰化钠可通过喷洒氧化剂双氧水的方式来处理,以减轻污染.
(1)写出NaCN的电子式Na+ ,偏碱性条件下,氰化钠溶液的CN-被双氧水氧化为HCO3-,同时放出NH3,该反应的离子方程式:CN-+H2O2+H2O═NH3↑+HCO3-;
,偏碱性条件下,氰化钠溶液的CN-被双氧水氧化为HCO3-,同时放出NH3,该反应的离子方程式:CN-+H2O2+H2O═NH3↑+HCO3-;
(2)Cu2+可作为双氧水氧化CN-中的催化剂.某兴趣小组要探究Cu2+对双氧水氧化CN-是否起催化作用,请你完成下实验方案.填写实验步骤、实验现象和结论(己知:CN-浓度可用离子色谱仪测定)
 Ⅰ.甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究.向A中通入氯气至过量,观察A中,发现溶液先呈红色,然后变为黄色.
Ⅰ.甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究.向A中通入氯气至过量,观察A中,发现溶液先呈红色,然后变为黄色.(1)B中反应的离子方程式是Cl2+2OH-═Cl-+ClO-+H2O;
(2)为了探究A中溶液由红色变为黄色的原因,甲同学进行如下实验.取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在Fe3+;
(3)资料显示:SCN -的电子式为
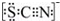 .甲同学猜想SCN-可能被Cl2氧化了,他进行了如下研究;
.甲同学猜想SCN-可能被Cl2氧化了,他进行了如下研究;①取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明
SCN-中被氧化的元素是硫元素;
②甲同学通过实验证明了SCN-中氮元素转化为NO3-,已知SCN-中碳元素没有被氧化,若SCN-与Cl2反应生成1mol CO2,则转移电子的物质的量是16mol;
Ⅱ.8.12天津港特大爆炸事故现场有700吨左右氰化钠,氰化钠剧毒.有少量因爆炸冲击发生泄漏.这些泄露的氰化钠可通过喷洒氧化剂双氧水的方式来处理,以减轻污染.
(1)写出NaCN的电子式Na+
 ,偏碱性条件下,氰化钠溶液的CN-被双氧水氧化为HCO3-,同时放出NH3,该反应的离子方程式:CN-+H2O2+H2O═NH3↑+HCO3-;
,偏碱性条件下,氰化钠溶液的CN-被双氧水氧化为HCO3-,同时放出NH3,该反应的离子方程式:CN-+H2O2+H2O═NH3↑+HCO3-;(2)Cu2+可作为双氧水氧化CN-中的催化剂.某兴趣小组要探究Cu2+对双氧水氧化CN-是否起催化作用,请你完成下实验方案.填写实验步骤、实验现象和结论(己知:CN-浓度可用离子色谱仪测定)
| 步骤:分别取等体积、等浓度的含氰废水于甲、乙两支试管中,再分别加入等体积、等浓度的双氧水溶液,只向甲试管中加入少量的无水硫酸铜粉末,用离子色谱仪测定相同反应时间内两支试管中的CN-浓度 | 现象与结论: 若甲试管中的CN-浓度小于乙试管中的CN-浓度,则Cu2+对双氧水破氰反应起催化作用 若两试管中的CN-浓度相同,则Cu2+对双氧水破氰反应不起催化作用 |
 )与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计如下三个实验方案:
)与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计如下三个实验方案: ②N2
②N2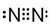 ③H2O
③H2O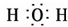 .
.