题目内容
【题目】(1)下面是我们熟悉的物质:
①O2 ②SO2 ③CaCl2 ④HNO3 ⑤NaOH ⑥NH4Cl
这些物质中,属于共价化合物的是 ___________;属于离子化合物的是___________;只含离子键的是___________。
(2)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。

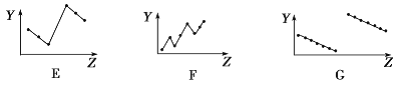
把与下面的元素有关性质相符的曲线的标号填入相应括号中:
①第ⅡA族元素的最外层电子数________________。
②第三周期离子Na+、Mg2+、Al3+、P3-、S2-、Cl-的离子半径________________。
③第二、三周期主族元素随原子序数递增原子半径的变化____________。
(3)已知某单核粒子的结构示意图为:![]()
①当x-y=10时,该粒子为____________(填“原子”、“阳离子”或“阴离子”)。
②当y=8时,若该微粒的氧化性很弱,得一个电子后变为原子,该微粒的符号是_____。
(4)已知A、B、C、D是中学化学中常见的四种10电子微粒,它们之间存在如图中转化关系。

请写出:A的化学式 (写一种); D的化学式 。
【答案】(1) ②④ ;③⑤⑥ ;③(2) ①B ②E ③G (3)①原子 ②K+ (4)HF(或NH4+);H2O
【解析】
试题分析:(1)只含共价键的化合物属于共价化合物,是②④;含有离子键的化合物属于离子化合物,是③⑤⑥;只含离子键的是③;
(2)①第ⅡA族元素的最外层电子数都是2,对应图像B;
②第三周期离子Na+、Mg2+、Al3+、P3-、S2-、Cl-的离子半径大小为P3->S2->Cl->Na+>Mg2+>Al3+,对应图像E;
③同一周期从左到右,半径逐渐减小,则第二、三周期主族元素随原子序数递增,原子半径的变化对应图像G;
(3)①当x-y=10时,核内质子数等于核外电子数,则该粒子为原子;
②当y=8时,若该微粒的氧化性很弱,得一个电子后变为原子,说明为19号元素,则该微粒的符号是K+;
(4)A、B、C、D是10电子微粒,发生反应A+B=C+D,则A、B可为OH-、NH4+,C、D为NH3、H2O。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案【题目】类比法是一种重要的化学思维方法。下列各项中的已知和类比结论均正确的是
选项 | 已知 | 类比结论 |
A | 汞可以用热分解法冶炼 | 铜也可以用热分解法冶炼 |
B | Mg-Al插入稀H2SO4溶液中构成 原电池,Mg作负极 | Mg-Al插入稀NaOH溶液中构成原电池,Mg也作负极 |
C | 硫元素的最高正化合价为+6 | 氧元素的最高正化合价也为+6 |
D | Si是半导体材料 | Ge也可作半导体材料 |
A.AB.BC.CD.D






