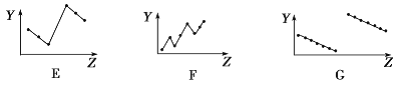题目内容
【题目】把0.6 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:2X(g)+Y(g) == nZ(g)+2W(g) 1 min末已生成0.2 mol W ,若测知以Z的浓度变化表示的反应速率为0.005 mol·L-1·s-1 ,计算:
(1)前1 min内用X的浓度变化表示的平均反应速率。
(2)1 min末时Y的浓度。
(3)化学反应方程式中n的值是多少?
【答案】(1)0.1 mol·L-1·min-1(2)0.25 mol·L-1(3)n=6
【解析】
试题分析:
2X(g)+Y(g) == nZ(g)+2W(g)
初始(mol) 0.6 0.6 0 0
转化(mol) 0.2 0.1 x 0.2
平衡(mol) 0.4 0.5 x 0.2
(1)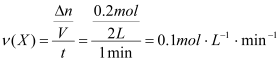 ;
;
(2)![]() ;
;
(3)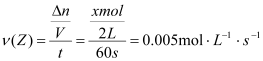 ,解得x=0.6又由于
,解得x=0.6又由于![]() ,可知,n=6。
,可知,n=6。
故前1min内用X的浓度变化表示的平均反应速率为)0.1 mol·L-1·min-1 ;1 min末时Y的浓度为0.25 mol·L-1 ;化学反应方程式中n的值为6。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目