题目内容
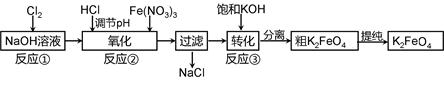
高铁酸钾是一种新型高效多功能水处理剂。工业上常采用NaClO氧化法生产,反应原理为:
①在碱性条件下,利用NaClO氧化Fe(NO3)3制得Na2FeO4
3NaClO + 2Fe(NO3)3 + 10NaOH=2Na2FeO4↓+ 3NaCl + 6NaNO3 + 5H2O
②Na2FeO4与KOH反应生成K2FeO4:Na2FeO4 + 2KOH=K2FeO4 + 2NaOH
主要的生产流程如下:
(1)加入盐酸调节溶液pH时需用pH试纸粗略测试pH以控制加入盐酸的量。实验室用pH试纸测定溶液pH的操作是 。
(2)流程图中“转化”(反应③)是在某低温下进行的,说明此温度下Ksp(K2FeO4) Ksp(Na2FeO4)(填“>”或“<”或“=”)。
(3)反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响。
图1为不同的温度下,Fe(NO3)3不同质量浓度对K2FeO4生成率的影响;
图2为一定温度下,Fe(NO3)3质量浓度最佳时,NaClO浓度对K2FeO4生成率的影响。
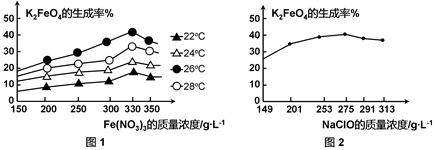
工业生产中最佳温度为 ℃,此时Fe(NO3)3与NaClO两种溶液最佳质量浓度之比为 。
(4)K2FeO4在水溶液中易“水解”:4FeO42- + 10H2O 4Fe(OH)3 + 8OH- + 3O2。在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 溶液(填序号)。
4Fe(OH)3 + 8OH- + 3O2。在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 溶液(填序号)。
(5)K2FeO4处理水时,不仅能消毒杀菌,还能除去水体中的H2S、NH3等,生成的Fe(OH)3胶体还能吸附水中的悬浮杂质。根据污染物的实际情况向水中加入适量的K2FeO4将污染物转化为无污染的物质,试写出K2FeO4处理含有NH3污水时与NH3反应的离子方程式 。
①在碱性条件下,利用NaClO氧化Fe(NO3)3制得Na2FeO4
3NaClO + 2Fe(NO3)3 + 10NaOH=2Na2FeO4↓+ 3NaCl + 6NaNO3 + 5H2O
②Na2FeO4与KOH反应生成K2FeO4:Na2FeO4 + 2KOH=K2FeO4 + 2NaOH
主要的生产流程如下:

(1)加入盐酸调节溶液pH时需用pH试纸粗略测试pH以控制加入盐酸的量。实验室用pH试纸测定溶液pH的操作是 。
(2)流程图中“转化”(反应③)是在某低温下进行的,说明此温度下Ksp(K2FeO4) Ksp(Na2FeO4)(填“>”或“<”或“=”)。
(3)反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响。
图1为不同的温度下,Fe(NO3)3不同质量浓度对K2FeO4生成率的影响;
图2为一定温度下,Fe(NO3)3质量浓度最佳时,NaClO浓度对K2FeO4生成率的影响。

工业生产中最佳温度为 ℃,此时Fe(NO3)3与NaClO两种溶液最佳质量浓度之比为 。
(4)K2FeO4在水溶液中易“水解”:4FeO42- + 10H2O
 4Fe(OH)3 + 8OH- + 3O2。在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 溶液(填序号)。
4Fe(OH)3 + 8OH- + 3O2。在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 溶液(填序号)。| A.H2O | B.CH3COONa、异丙醇 | C.NH4Cl、异丙醇 | D.Fe(NO3)3、异丙醇 |
(12分,每空2分)(1)取一小块试纸放在表面皿或玻璃片上,用玻璃棒蘸取待测液,点在pH试 纸上,半分钟后与标准比色卡对照 (2)< (3)①26 6:5 (4)B
(5)2FeO42-+2NH3+2H2O=2Fe(OH)3(胶体)+N2↑+ 4OH-
或(2FeO42-+2NH3·H2O=2Fe(OH)3(胶体)+N2↑+ 4OH-)(把胶体写成↓也可。)
(5)2FeO42-+2NH3+2H2O=2Fe(OH)3(胶体)+N2↑+ 4OH-
或(2FeO42-+2NH3·H2O=2Fe(OH)3(胶体)+N2↑+ 4OH-)(把胶体写成↓也可。)
试题分析:(1)实验室用pH试纸测定溶液的pH值的正确操作是取一小块试纸放在表面皿或玻璃片上,用玻璃棒蘸取待测液,点在pH试纸上,半分钟后与标准比色卡对照即可。
(2)由流程图可知,“转化”(反应③)是Na2FeO4→K2FeO4,该转化是在某低温下进行的,根据沉淀更容易向生成更难溶的方向进行可知,此温度下K2FeO4的溶解度小于Na2FeO4,所以Ksp(K2FeO4)<Ksp(Na2FeO4)。
(3)由图1可知,在Fe(NO3)3浓度一定时,温度在26℃时,K2FeO4的生成率最高,故工业生产中最佳温度为26℃。由图1可知,Fe(NO3)3浓度在330g/L时,K2FeO4的生成率最高。由图2可知,NaClO在2575g/L时,K2FeO4的生成率最高,所以Fe(NO3)3与NaClO两种溶液最佳质量浓度之比为330g/L:275g/L=6:5。
(4)K2FeO4 在水溶液中易水解呈碱性,应选择碱性非水溶液抑制K2FeO4水解,进行洗涤。A、H2O不能抑制水解,且容易损失,故A错误;B、CH3COONa溶于水水解显碱性、异丙醇,能抑制水解,减少洗涤损失,故B正确;C、NH4Cl溶于水水解显酸性,不能抑制水解,促进水解,故C错误;D、Fe(NO3)3溶于水水解显酸性,不能抑制水解,促进水解,故D错误,答案选B。
(5)向含有NH3污水中加入适量的K2FeO4将污染物转化为无污染的物质,则该无毒的物质是氮气,而高铁酸钾的还原产物是氢氧化铁,其中氮元素的化合价从-3价升高到0价,失去3个电子。铁元素的化合价从+6价降低到+3价,得到3个电子,因此氧化剂高铁酸钾与还原剂氨气的物质的量之比是1:1,根据原子守恒可知反应的离子方程式为2FeO42-+2NH3+2H2O=2Fe(OH)3(胶体)+N2↑+ 4OH-或(2FeO42-+2NH3·H2O=2Fe(OH)3(胶体)+N2↑+ 4OH-)。

练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案
相关题目
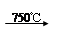 8Na2CrO4 + 2 Fe2O3 + 8CO2↑;
8Na2CrO4 + 2 Fe2O3 + 8CO2↑; 2CrO42- + 2H+
2CrO42- + 2H+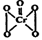 ), 该反应可用来检验Cr2O72-的存在。写出反应的离子方程式: 。
), 该反应可用来检验Cr2O72-的存在。写出反应的离子方程式: 。
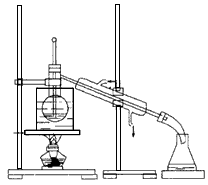
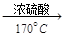 CH2=CH2↑+H2O,由于浓硫酸具有强氧化性,其副产物有二氧化硫和二氧化碳等。某同学根据上述信息和实验目标选择下列实验装置设计实验探究(每种装置都有若干个):
CH2=CH2↑+H2O,由于浓硫酸具有强氧化性,其副产物有二氧化硫和二氧化碳等。某同学根据上述信息和实验目标选择下列实验装置设计实验探究(每种装置都有若干个):