题目内容
下列比较中正确的是
A.金属性:Mg>Al>Na B.原子半径:S>O>F
C.碱性:KOH>Mg(OH)2>NaOH D.氢化物的稳定性:HBr>HCl>PH3
【答案】
B
【解析】
试题分析:A、钠、镁、铝都是第三周期元素,原子序数逐渐增大。同周期自左向右金属性逐渐减弱,因此金属性是Na>Mg>Al,A不正确;B、S和O属于同一主族,自上而下原子半径逐渐增大。O和F都是第二周期元素,自左向右原子半径逐渐减小,因此原子半径是S>O>F,B正确;C、金属性越强,最高价氧化物对应水化物的碱性越强。金属性是K>Na>Mg,所以碱性是KOH>NaOH>Mg(OH)2,C不正确;D、非金属性越强,氢化物的稳定性越强。非金属性是Cl>Br>P,所以氢化物的稳定性是HCl>HBr>PH3,D不正确,答案选B。
考点:考查元素周期律的应用

练习册系列答案
相关题目
a、b、c、d是四种短周期元素.a、b、d同周期,c、d同主族.a的原子结构示意图为 ,b与c形成化合物的电子式为
,b与c形成化合物的电子式为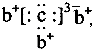 下列比较中正确的是( )
下列比较中正确的是( )
 ,b与c形成化合物的电子式为
,b与c形成化合物的电子式为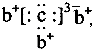 下列比较中正确的是( )
下列比较中正确的是( )| A、原子半径:a>c>d>b | B、最高价含氧酸的酸性c>d>a | C、原子序数:a>d>b>c | D、单质的氧化性a>b>d>c |
 ,b与c形成化合物的电子式为
,b与c形成化合物的电子式为 .下列比较中正确的是( )
.下列比较中正确的是( )