题目内容
下列比较中正确的是( )
分析:A、元素非金属性越强,对应离子的还原性越弱;
B、元素非金属性越强,对应单质的氧化性越强;
C、元素非金属性越强,对应最高价氧化物的水化物的酸性越强;
D、同周期元素从左向右非金属性增强,同主族元素从上到下非金属性减弱.
B、元素非金属性越强,对应单质的氧化性越强;
C、元素非金属性越强,对应最高价氧化物的水化物的酸性越强;
D、同周期元素从左向右非金属性增强,同主族元素从上到下非金属性减弱.
解答:解:A、因非金属性:Cl>Br>I>S,则离子的还原性为S2->I->Br->Cl-,故A错误;
B、因非金属性:F>Cl>Br>S,则单质的氧化性:F2>Cl2>Br2>S,故B正确;
C、因非金属性:Cl>S>P,则对应最高价氧化物的水化物的酸性为:HClO4>H2SO4>H3PO4,故C错误;
D、同周期元素从左向右非金属性增强,则F>O,Cl>S,同主族元素从上到下非金属性减弱,则O>S,故D错误;
故选B.
B、因非金属性:F>Cl>Br>S,则单质的氧化性:F2>Cl2>Br2>S,故B正确;
C、因非金属性:Cl>S>P,则对应最高价氧化物的水化物的酸性为:HClO4>H2SO4>H3PO4,故C错误;
D、同周期元素从左向右非金属性增强,则F>O,Cl>S,同主族元素从上到下非金属性减弱,则O>S,故D错误;
故选B.
点评:本题考查元素的性质,熟悉元素周期律及非金属性的比较方法即可解答,难度不大.

练习册系列答案
相关题目
a、b、c、d是四种短周期元素.a、b、d同周期,c、d同主族.a的原子结构示意图为 ,b与c形成化合物的电子式为
,b与c形成化合物的电子式为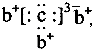 下列比较中正确的是( )
下列比较中正确的是( )
 ,b与c形成化合物的电子式为
,b与c形成化合物的电子式为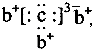 下列比较中正确的是( )
下列比较中正确的是( )| A、原子半径:a>c>d>b | B、最高价含氧酸的酸性c>d>a | C、原子序数:a>d>b>c | D、单质的氧化性a>b>d>c |
 ,b与c形成化合物的电子式为
,b与c形成化合物的电子式为 .下列比较中正确的是( )
.下列比较中正确的是( )