题目内容
【题目】(12分)人体必需的元素包括常量元素与微量元素,常量元素包括碳、氢、氧、氮、钙、镁等,微量元素包括铁、铜、锌、氟、碘等,这些元素形成的化合物种类繁多,应用广泛。
(1)锌、铜、铁、钙四种元素与少儿生长发育息息相关,请写出Fe2+的核外电子排布式__________。
(2)1个Cu2+与2个H2N—CH2—COO形成含两个五元环结构的内配盐(化合物),其结构简式为_______________(用→标出配位键),在H2N—CH2—COO中,属于第二周期的元素的第一电离能由大到小的顺序是__________(用元素符号表示),N、C原子存在的相同杂化方式是_________杂化。
(3)碳酸盐中的阳离子不同,热分解温度就不同,查阅文献资料可知,离子半径r(Mg2+)=66 pm,r(Ca2+)=99 pm,r(Sr2+)=112 pm,r(Ba2+)=135 pm;碳酸盐分解温度T(MgCO3)=402℃,T(CaCO3)=825℃,T(SrCO3)=1172℃,T(BaCO3)=1360℃。分析数据得出的规律是_____________,解释出现此规律的原因是____________________________________。
(4)自然界的氟化钙矿物为萤石或氟石,CaF2的晶体结构呈立方体形,其结构如下:
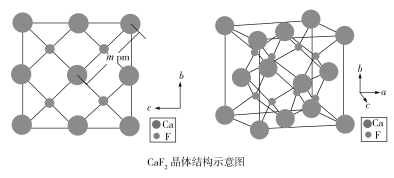
①两个最近的F之间的距离是___________pm(用含m的代数式表示)。
②CaF2晶胞体积与8个F形成的立方体的体积比为___________。
③CaF2晶胞的密度是___________g·cm3(化简至带根号的最简式,NA表示阿伏加德罗常数的值)。
【答案】[Ar]3d6(或1s22s22p63s23p63d6 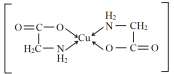 N>O>C sp3 随着这类金属阳离子半径的增大,碳酸盐的热分解温度逐渐升高 金属离子半径越小,其与碳酸根离子中氧的作用力越强,与碳的作用力则减弱,对应的碳酸盐就越容易分解(或其他合理答案)
N>O>C sp3 随着这类金属阳离子半径的增大,碳酸盐的热分解温度逐渐升高 金属离子半径越小,其与碳酸根离子中氧的作用力越强,与碳的作用力则减弱,对应的碳酸盐就越容易分解(或其他合理答案) ![]() 8∶1
8∶1 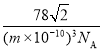
【解析】
(1)Fe的核电荷数为26,核外电子排布式[Ar]3d64s2或1s22s22p63s23p63d64s2,Fe2+的核外电子排布式为[Ar]3d6或1s22s22p63s23p63d6。
(2)1个Cu2+与2个H2N—CH2—COO形成的盐,因为含两个五元环结构,所以结构为 ;在H2N—CH2—COO中,属于第二周期元素的是C、N、O,第一电离能由大到小的顺序是N>O>C,在H2N—CH2—COO中,N的杂化方式为sp3、C的杂化方式为sp3和sp2,相同的是sp3杂化。
;在H2N—CH2—COO中,属于第二周期元素的是C、N、O,第一电离能由大到小的顺序是N>O>C,在H2N—CH2—COO中,N的杂化方式为sp3、C的杂化方式为sp3和sp2,相同的是sp3杂化。
(3)随着金属离子半径的增大,碳酸盐的热分解温度逐步升高;一般认为,含氧酸盐热分解的本质是金属离子争夺含氧酸根中的氧元素,金属离子的半径越小,夺取含氧酸根中的氧的能力越强,含氧酸盐的热分解温度越低,越易分解。
(4)①根据侧面图可看出,2m pm为面对角线的长度,边长为![]() pm,两个最近的F之间的距离为立方体边长的一半,所以两个最近的F之间的距离为
pm,两个最近的F之间的距离为立方体边长的一半,所以两个最近的F之间的距离为![]() pm。
pm。
②观察晶胞,可看出8个F形成的小立方体的边长为CaF2晶胞边长的![]() ,所以CaF2晶胞体积与8个F形成的立方体的体积比为(2∶1)3=8∶1。
,所以CaF2晶胞体积与8个F形成的立方体的体积比为(2∶1)3=8∶1。
③根据图示可知CaF2晶胞中含4个Ca2+和8个F,它的边长为![]() pm=
pm=![]() ×1010 cm,利用ρVNA =4M得出ρ=
×1010 cm,利用ρVNA =4M得出ρ=![]() g·cm3=
g·cm3=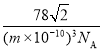 g·cm3。
g·cm3。