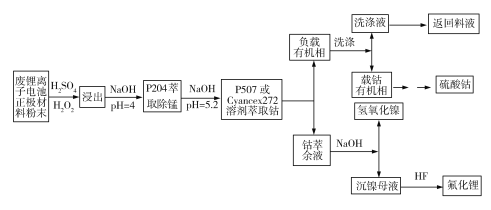
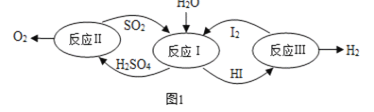
题目内容
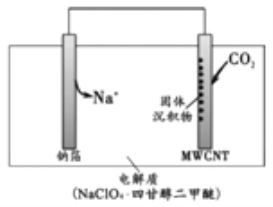
【题目】某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3, 其原理如图所示,其中A、B为多孔材料。下列说法正确的是

A. 电解质溶液中电流的方向由B到A,电子的流向与之相反
B. 电极A表面反应之一为NO-3e-+2H2O=NO3-+4H+
C. 电极B附近的c(NO3-)增大
D. 该电池工作时,每转移4 mol电子,消耗22.4 LO2
【答案】B
【解析】
由示意图可知,该装置为原电池,电池工作时通入汽车尾气(NO、NO2)的A极为负极,尾气在负极失电子发生氧化反应生成HNO3,电极反应式为NO2-e-+H2O=NO3-+2H+或NO-3e-+2H2O=NO3-+4H+,通入氧气的B极为正极,正极上氧气得电子发生还原反应,电极反应式为O2+4e-+4H+=2H2O。
A项、电解质溶液中是通过阴阳离子的定性移动形成电流,故A错误;
B项、该原电池中,通入氮氧化物的A电极是负极,负极上氮氧化物失电子发生氧化反应生成硝酸,电极A表面反应之一为NO-3e-+2H2O=NO3-+4H+,故B正确;
C项、通入氧气的B极为正极,正极上氧气得电子发生还原反应,电极反应式为O2+4e-+4H+=2H2O,放电时有水生成,电极B附近硝酸根离子浓度减小,故C错误;
D项、没有明确是否为标准状况,无法计算氧气体积,故D错误。
故选B。

练习册系列答案
相关题目