题目内容
某研究小组用黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备ClO2气体,再用水吸收该气体可得ClO2溶液。在此过程中需要控制适宜的温度,若温度不当,副反应增加,影响生成ClO2气体的纯度,且会影响ClO2的吸收率,具体情况如图所示。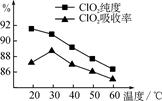
(1) 据图可知,反应时需要控制的适宜温度是________℃,要达到此要求需要采取的措施是______________。
(2) 已知:黄铁矿中的硫元素在酸性条件下可被ClO3-氧化成SO42-,请写出FeS2、氯酸钠和硫酸溶液混合反应生成二氧化氯(ClO2)的离子方程式:______________________。
(3) 该小组拟以“m(ClO2)/m(NaClO3)”作为衡量ClO2产率的指标。若取NaClO3样品6.0 g,通过反应和吸收获得400 mL ClO2溶液,取此溶液20 mL与37.00 mL 0.500 mol·L-1 (NH4)2Fe(SO4)2溶液充分反应后,过量的Fe2+再用0.050 0 mol·L-1 K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液20.00 mL。反应原理为:
4H++ClO2+5Fe2+=Cl-+5Fe3++2H2O
14H++Cr2O72-+6Fe2+=2Cr3++6Fe3++7H2O
试计算ClO2的“产率”(写出计算过程)。
(1)30℃(2分) 水浴加热(或水浴控制恒温等合理答案均可)(2分)
(2)15ClO3-+FeS2+14H+=15ClO2+Fe3++7H2O+2SO42-(2分)
(3)由Cr2O72- ~ 6Fe2+
1 6
0.05 mol·L-1×20 mL×10-3 n(Fe2+)
得n(Fe2+)=6×10-3 mol
由ClO2 ~ 5Fe2+
1 5
n(ClO2) 0.5 mol·L-1×37 mL×10-3-6×10-3 mol
得n(ClO2) =2.5×10-3 mol
所以,ClO2的产率=[(2.5×10-3 mol×20×67.5 g·mol-1)/6.0 g]×100%=56.25%(7分)
解析试题分析::(1)ClO2气体的纯度,且会影响ClO2的吸收率,依据图象分析温度再30°C时ClO2的吸收率最大纯度90%以上,控制100°C以下的温度需要用水浴加热;故答案为:30℃;水浴加热;(2)用黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备ClO2气体,氯酸跟离子在酸溶液中具有强氧化性,氧化FeS2为硫酸铁和硫酸,本身被还原为反应的离子方程式为ClO2;结合原子守恒、电子守恒配平写出离子方程式为:15ClO3-+FeS2+14H+═15ClO2+Fe3++7H2O+2SO42-;
答案为:15ClO3-+FeS2+14H+═15ClO2+Fe3++7H2O+2SO42-;
(3)由Cr2O72- ~ 6Fe2+
1 6
0.05 mol·L-1×20 mL×10-3 n(Fe2+)
得n(Fe2+)=6×10-3 mol
由ClO2 ~ 5Fe2+
1 5
n(ClO2) 0.5 mol·L-1×37 mL×10-3-6×10-3 mol
得n(ClO2) =2.5×10-3 mol
所以,ClO2的产率=[(2.5×10-3 mol×20×67.5 g·mol-1)/6.0 g]×100%=56.25%。
考点:本题考查了化学方程式计算应用,反应条件选择,离子方程式书写,题目难度中等。

在灾后重建中,饮用水安全占有极为重要的地位,某研究小组提取三处被污染的水源进行分析,并给出了如下实验信息:其中一处被污染的水源含有A、B两种物质,一处含有C、D两种物质,一处含有E物质,A、B、C、D、E五种常见化合物都是由下表中的离子形成的:
| 阳离子 | K+、Na+、Cu2+、Al3+ |
| 阴离子 | SO42—、HCO3—、NO3—、OH- |
为了鉴别上述化合物,分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液。
②将E溶液滴入到C溶液中,出现白色沉淀,继续滴加沉淀溶解。
③进行焰色反应实验,只有B、C含有钾离子。
④在各溶液中加入Ba(NO3)2溶液,再加入过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀。
⑤将B、D两溶液混合,未见沉淀或气体生成。
根据上述实验现象填写下列空白:
(1)写出B、C、D的化学式:B________、C________、D________。
(2)将含1 mol A的溶液与含1 mol E的溶液反应后蒸干,仅得到一种化合物,该化合物为________。
(3)写出实验②发生反应的离子方程式________________________________________
(4)C常用作净水剂,用离子方程式表示其净水原理_______________________________
某兴趣小组在课外活动中对某溶液进行了多次的检测,其中的三次检测结果如下表所示,请回答下列问题:
| | 溶液中检测出的溶质 |
| 第一次 | KCl、K2SO4、Na2CO3、NaCl |
| 第二次 | KCl、BaCl2、Na2CO3、NaCl |
| 第三次 | KCl、K2CO3、Na2SO4、NaCl |
(1)三次检测结果中,第 次的结果肯定不正确。
(2)在检测时,为了确定溶液中是否存在SO42-、CO32-和Cl-,该小组的学生进行了如下表所示的实验,请仔细分析实验,将表格补充完整:
| 实验步骤 | 实验操作 | 实验目的 | 反应的离子方程式 |
| 第一步 | 向溶液中滴加过量的硝酸 | 检验 ① 的存在 | ② |
| 第二步 | 继续滴加过量的 ③ 溶液 | 检验SO42-的存在 | ④ |
| 第三步 | 过滤,再向滤液中滴加 ⑤ 溶液 | 检验 ⑥ 的存在 | Ag++Cl- = AgCl↓ |
(3)在上述实验的第一步中,能否将硝酸改为稀盐酸? (填“能”或“不能”,如果填“能”,则不用说理由;如果填“不能”,则说明理由)。
某溶液中仅含下表离子中的5种离子(不考虑水的电离及离子的水解),且离子的物质的量均为1mol。
| 阴离子 | SO42-、NO3-、Cl- |
| 阳离子 | Fe3+、Fe2+、NH4+、Cu2+、Al3+ |
①若向原溶液中加入KSCN溶液,无明显变化。②若向原溶液中加入过量的盐酸,有气体生成,溶液中阴离子种类不变。③若向溶液中加入BaCl2溶液,有白色沉淀生成试回答下列问题。
(1)若先向原溶液中加入过量的盐酸,再加入KSCN溶液,现象是 。
(2)原溶液中含有的阳离子是 。
(3)向原溶液中加入足量的盐酸,发生反应的离子方程式为 。
(4)向原溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体用托盘天平称量质量为 。
