��Ŀ����
����Ŀ��SO2����Ϊ������������Ի�����Σ��������Ϊ_______________��Ϊ�˼���Σ�������ǽ��������������̽�����о���������ʵ��Ӧ����ȡ����һ���ijɹ���
��1����ҵ�ϳ�����ʯ��������ú̿�е�SO2������������SO2����_______����������ʡ�
��2�������������������һ�����õ�ⱥ���Ȼ�����Һ��ѭ����������������ķ��������ն�������ķ������÷������������£�
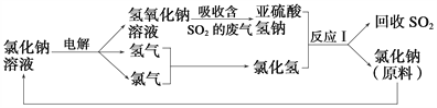
�ٴ��ַ����У�����ѭ�����õ�������_____________________________��
��д����Ӧ������ӷ���ʽ��_____________________________________��
��3��SO2ͨ�����й������̿��Ʊ�����ԭ��H2SO4�������ԴH2
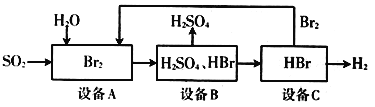
����˵������ȷ����____________ ��
A. �豸A�е���ˮ��ɫ��������SO2��Ư����
B. ���������յ��ŵ㣺Br2����ѭ�����ã�����������ԴH2
C. �ù������̵��ܷ�Ӧ����ʽΪ��SO2+2H2O=H2SO4+H2
D. �豸B�����ʷ������Ϊ����
���𰸡� �γ����� ���� �Ȼ��� HSO3-+H+==H2O+SO2�� BC
����������1�������������������ʹ��ú��ʯ�͡���Ȼ���Ȼ�ʯȼ�ϣ�ȼ�պ���������������������ڴ����о������ӵĻ�ѧ��Ӧ���γɣ�����������м����Σ������˱���Ϊ��������������������������������������CaO��Ӧ����������ƣ�������Ʋ��ȶ������ױ�����������������������ƣ���2���ٸ���ͼ֪�����Ȼ�����Һ���õ�NaOH�����������������������ƺ�ϡ���ᷴӦ�����Ȼ��ơ����������ˮ�������ѭ�����õ��������Ȼ��ƣ������������ƺ�ϡ���ᷢ�����ֽⷴӦ�����Ȼ��ơ����������ˮ�����ӷ�Ӧ����ʽΪHSO3-+H+��H2O+SO2������3��A. �豸A�е���ˮ��ɫ��������SO2�Ļ�ԭ�ԣ�A����B. ��Ӧǰ�����壬��Ӧ�������壬��˸��������յ��ŵ㣺Br2����ѭ�����ã�����������ԴH2��B��ȷ��C. ������ʼԭ�Ϻ����ղ�Ʒ��֪�ù������̵��ܷ�Ӧ����ʽΪ��SO2+2H2O��H2SO4+H2��C��ȷ��D. ����������ụ�ܣ��豸B�����ʷ������Ӧ����������Ϊ���ˣ�D����ѡBC��

 �±�Сѧ��Ԫ�Բ���ϵ�д�
�±�Сѧ��Ԫ�Բ���ϵ�д� �ִʾ��ƪϵ�д�
�ִʾ��ƪϵ�д�����Ŀ��ʵ������������������Ҫװ����ͼ1��ʾ����Ҫ�������a�Թ��а�2��3��2�����������Ũ���ᡢ�Ҵ�������Ļ���
�ڰ�Aͼ����װ�ã�ʹ����������������ͨ��b�Թ���ʢ�ı���̼������Һ�����뼸�η�̪��Һ���У�
��С�����a�Թ��еĻ��Һ��
�ܵ�b�Թ����ռ���Լ2mL����ʱֹͣ���ȣ�����b�Թܲ�������Ȼ���ô�����Һ��ֲ㣻
�ݷ��������������������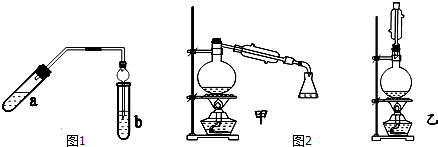
��ش��������⣺
��1��������пɹ۲쵽b�Թ�����ϸС������ð����д���÷�Ӧ�����ӷ���ʽ�� ��
��2��Aװ����ʹ�����ιܳ������������⣬��һ��Ҫ������ �� ������з���������������ʹ�õ�һ�������� ��
��3��Ϊ֤��Ũ�����ڸ÷�Ӧ�����˴�������ˮ�������ã�ijͬѧ������ͼA��ʾװ�ý���������4��ʵ�飮ʵ�鿪ʼ���þƾ�����3min���ټ���ʹ֮����3min��ʵ�����������С�Թ�b�ٲ��л���ĺ�ȣ�ʵ���¼���£�
ʵ���� | �Թ�a���Լ� | �Թ�b���Լ� | ����л���ĺ��/cm |
A | 3mL�Ҵ���2mL���ᡢ1mL18molL��1 Ũ���� | ����Na2CO3��Һ | 5.0 |
B | 3mL�Ҵ���2mL���� | 0.1 | |
C | 3mL�Ҵ���2mL���ᡢ6mL 3molL��1 H2SO4 | 1.2 | |
D | 3mL�Ҵ���2mL���ᡢ���� | 1.2 |
��ʵ��D��Ŀ������ʵ��C����գ�֤��H+��������Ӧ���д����ã�ʵ��D��Ӧ��������������Ũ�ȷֱ���mL��molL��1 ��
�ڷ���ʵ������ʵ���ţ������ݣ������Ʋ��ŨH2SO4����ˮ����������������IJ��ʣ�Ũ�������ˮ���ܹ���������������ʵ�ԭ���� ��
�ۼ���������������������IJ��ʣ���ʵ�鷢���¶ȹ������������IJ��ʷ������ͣ����ܵ�ԭ���� ��
�ܷ�����������������ϴ�����ʣ�Ϊ�˸�������������ѡ�õĸ����Ϊ������ĸ�� ��
A��P2O5 B����ˮNa2SO4 C����ʯ�� D��NaOH����
��Ϊ������÷�Ӧ���ͬѧ�������ͼ2�мס�������װ�ã�������װ��ʱ������Ӧ�����ȴ�����ñ���̼������Һ��ȡ��ƿ�еIJ��������Ϊ���������� �� �����ǣ� ��