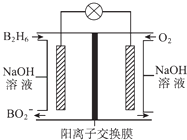
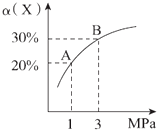
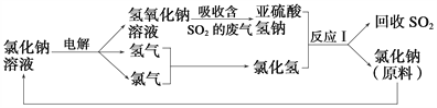
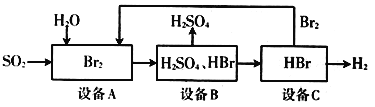
题目内容
【题目】在密闭容器中充入4mol SO2和3mol O2 一定条件下建立平衡2SO2(g)+O2(g)═2SO3(g)△H=﹣Q KJ/mol,测得SO2的转化率为90%,则在此条件下,反应放出的热量为( )
A.1.8Q KJ
B.2Q KJ
C.Q KJ
D.0.9Q KJ
【答案】A
【解析】解:设反应放出的热量为x,由
2SO2(g)+ | O2(g) | 2SO3(g) | △H=﹣Q KJ/mol | |
2 | QkJ | |||
4mol×90% | x |
![]() =
= ![]() ,
,
解得x=1.8QkJ,
故选A.
由2SO2(g)+O2(g)2SO3(g)△H=﹣Q KJ/mol可知,2molSO2完全反应放出QkJ的热量,则SO2的转化率为90%,则反应的SO2为4mol×90%=3.6mol,利用物质的量与反应放出的热量成正比来解答.

练习册系列答案
相关题目