题目内容
【题目】硝酸铵是一种重要的化工原料,通常用合成氨及合成硝酸的产物进行生产
(1)硝酸铵水溶液pH__________7(填“>”、“=”或“<”),其水溶液中各种离子浓度大小关系为___________
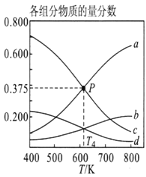
(2)已知合成氨的热化学方程式为:N2(g)+ 3H2(g)![]() 2NH3(g)△H=-92kJ/mol,按照氮气和氢气的物质的量之比1:3的比例,分别在200℃、400℃、600℃的条件下进行反应,生成物NH3的物质的量分数随压强的变化曲线如图所示
2NH3(g)△H=-92kJ/mol,按照氮气和氢气的物质的量之比1:3的比例,分别在200℃、400℃、600℃的条件下进行反应,生成物NH3的物质的量分数随压强的变化曲线如图所示
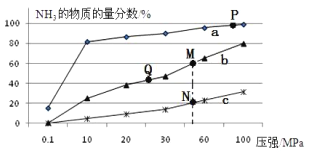
①曲线c对应的温度为___________ ℃
②下列说法中正确的是___________
A.增大氢气浓度,可促进平衡正向移动并能提高氮气的转化率
B.Q点对应的反应条件下,若加入适当的催化剂,可提高NH3在混合物中的物质的量分数
C.M、N两点的平衡常数大小关系为:M>N
D.M、N、Q三点反应速率的大小关系为:N>M>Q
E.为了尽可能多的得到NH3,应当选择P点对应的温度和压强作为生产条件
(3)尿素[CO(NH2)2]是一种非常重要的高效氮肥,工业上以NH3、CO2为原料生产尿素,该反应实际为两步反应:
第一步:2NH3(g)+CO2(g)=H2NCOONH4(s) ΔH=-272kJ·mol-1
第二步:H2NCOONH4(s)=CO(NH2)2(s)+H2O(g) ΔH=+138kJ·mol-1
写出工业上以NH3、CO2为原料合成尿素的热化学方程式:_________________________
(4)柴油汽车尾气净化器通常用尿素作为氮氧化物尾气的吸收剂,生成物均为无毒无污染的常见物质,请写出尿素与NO反应的化学方程式__________,当有1mol尿素完全反应时,转移电子的数目为___________
【答案】< NO3->NH4+>H+>OH- 600 ACD 2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g) ΔH=-134kJ·mol-1 2CO(NH2)2 + 6NO = 2CO2 + 5N2 + 4H2O 6NA
【解析】
(1)硝酸铵溶于水NH4+易水解,NH4++H2O![]() NH3.H2O +H+,因此溶液呈弱酸性,即pH<7,水溶液中各种离子浓度大小关系为NO3->NH4+>H+>OH-;
NH3.H2O +H+,因此溶液呈弱酸性,即pH<7,水溶液中各种离子浓度大小关系为NO3->NH4+>H+>OH-;
(2)①相同压强下,升高温度平衡逆向移动,氨气含量降低,根据图知,a、b、c的温度分别是200℃、400℃、600℃,因此,本题正确答案是:600℃;
②A.增大氢气浓度,即增加反应物浓度,可促进平衡正向移动并能提高氮气的转化率,故A正确;
B.催化剂只能相同程度的改变正逆反应速率,不能使化学平衡移动,故B错误;
C.M、N两点压强相同,M和N的温度不同,M点氨气质量分数大于N,说明平衡常数M>N,故C正确;
D.两点压强相同,M点的温度低于N的温度,所以反应速率N>M,M和Q的温度相同,压强M大于Q,所以反应速率M>Q,故D正确;
综上所述,本题应选ACD;
(3)已知反应①2NH3(g)+CO2(g)=H2NCOONH4(s) ΔH1=-272kJ·mol-1,反应②H2NCOONH4(s)=CO(NH2)2(s)+H2O(g) ΔH2=+138kJ·mol-1
根据盖斯定律,由①+②式得2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g) ΔH= ΔH1+ΔH2=-134kJ·mol-1
(4)根据尿素作为氮氧化物尾气的吸收剂,生成物均为无毒无污染的常见物质,可知生成物应为氮气、二氧化碳和水,CO(NH2)2 中N化合价由-3价升为0价,NO中N的化合价由+2价降为0价,根据得失电子守恒可知CO(NH2)2 与NO反应中的系数之比为1:3,根据质量守恒可配平方程式:2CO(NH2)2 + 6NO = 2CO2 + 5N2 + 4H2O,1mol尿素完全反应时,转移电子6mol,即数目为6NA个。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案