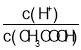题目内容
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶液平衡均属于化学平衡。
(1)已知H2A在水中存在以下平衡:H2A=H++HA-,HA-H++A2-。
①NaHA溶液的pH___(填大于、小于或等于)Na2A溶液的pH。
②某温度下,若向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/LKOH溶液至溶液呈中性。此时该混合溶液中下列关系中,一定正确的是__。
A.c(H+)c(OH-)=1×10-14 B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+) D.c(Na+)+c(K+)=0.05mol/L
③已知常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s)Ca2+(aq)+A2-(aq)ΔH>0。若要使该溶液中Ca2+浓度变小,可采取的措施有___。
A.升高温度 B.降低温度 C.加入NH4Cl晶体 D.加入Na2A固体
(2)常温下,若在0.10molL-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=___molL-1(Ksp[Cu(OH)2]=2.2×10-20)。
【答案】小于 BC BD 2.2×10-8
【解析】
(1)①H2A在水中存在以下平衡:H2A=H++HA-,HA-H++A2-,第一步完全电离,HA-离子只存在电离不发生水解;②混合溶液呈中性,则c(H+)=c(OH-),溶液呈存在物料守恒和电荷守恒,注意离子积常数只与温度有关;③影响沉淀溶解平衡移动的因素有温度和浓度;(2)溶度积常数及溶液中氢氧根离子浓度计算出c(Cu2+)。
(1)①根据酸的电离方程式分析,NaHA中HA-只有电离没有水解,溶液显酸性,而NaA溶液中A2-水解,溶液显碱性,所以前者pH小,故答案为:小于;
②A、题目说是某温度下,不能确定水离子积常数,故错误;
B、根据电荷守恒c(Na+)+c(K+)+c(H+)=c(HA-)+2c(A2-)+c(OH-)分析,溶液为中性,氢离子浓度等于氢氧根离子浓度,故正确;
C、若完全反应生成正盐,则溶液为碱性,所以氢氧化钾的物质的量小于NaHA,即钠离子浓度大于钾离子浓度,故正确;
D、因为氢氧化钾的物质的量比NaHA少,故二者浓度和小于0.05mol/L,故错误,故答案为:BC;
③A、升温,平衡正向移动,钙离子浓度增大,故错误;
B、降低温度,平衡逆向移动,钙离子浓度减小,故正确;
C、加入氯化铵晶体,溶液的碱性减弱,A2-水解平衡正向移动,钙离子浓度增大,故错误;D、加入盐,平衡逆向移动,钙离子浓度减小,故正确,故答案为:BD;
(2)铜离子浓度为![]() =2.2×10-8,故答案为:2.2×10-8。
=2.2×10-8,故答案为:2.2×10-8。