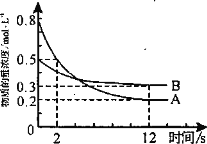
题目内容
【题目】李比希法常用于测定有机物的组成。如图是确定有机物化学式常用的装置,其中管式炉可提供有机物燃烧所需的高温。
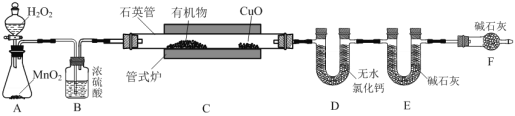
(1)装置C中CuO的作用是___。
(2)装置F的作用是___。
(3)准确称取13.60g有机物(只含C、H、O三种元素中的两种或三种),经充分燃烧后,D管质量增加7.20g,E管质量增加35.20g。
①该有机物的最简式为___。
②若该有机物的相对分子质量为68,能发生银镜反应,且有2种不同化学环境的氢原子,该有机物的结构简式为___。
③若该有机物的相对分子质量为136,分子内含有一个苯环,且能与NaHCO3反应,其核磁共振氢谱有4个峰,该有机物的结构简式为___。
【答案】将燃烧产生的CO转化为CO2 吸收空气中的水和CO2 C4H4O CH3C≡CCHO ![]()
【解析】
双氧水在二氧化锰催化作用下生成氧气,用浓硫酸干燥后通入C与有机物反应,CuO将有机物未完成燃烧产生的CO转化为CO2,用无水氯化钙吸收生成的水,碱石灰吸收二氧化碳;利用生成的二氧化碳和水的质量,通过计算得到有机物的最简式。
(1)装置C中有机物与氧气反应时有可能未完全燃烧,对后面碳的测定有影响,所以使用CuO的作用是将燃烧产生的CO转化为CO2;
(2)装置D、E吸收的水和CO2,只能来自于燃烧生成的,所以F的作用是吸收空气中的水和CO2;
(3)①D管吸收的是水,质量增加7.20g,即水为7.20g,E管吸收的是二氧化碳,增加35.20g,即二氧化碳为35.20g,![]() ,n(H)=0.8mol,m(H)=0.8mol×1g/mol=0.8g,
,n(H)=0.8mol,m(H)=0.8mol×1g/mol=0.8g,![]() ,n(C)=0.8mol,m(C)=0.8mol×12g/mol=9.6g,m(O)= 13.60g-9.6g-0.8g=3.2g,
,n(C)=0.8mol,m(C)=0.8mol×12g/mol=9.6g,m(O)= 13.60g-9.6g-0.8g=3.2g,![]() ,n(C):n(H):n(O)=0.8:0.8:0.2=4:4:1,最简式为C4H4O;
,n(C):n(H):n(O)=0.8:0.8:0.2=4:4:1,最简式为C4H4O;
②根据相对分子质量为68,假设有机物分子式为(C4H4O)n,(12×4+1×4+16) ×n=68,解得n=1,分子式为C4H4O,能发生银镜反应说明有-CHO,且有2种不同化学环境的氢原子,说明剩下的三个氢原子是一种类型,即为甲基中氢,还有两个碳形成三键,所以该有机物的结构简式为CH3C≡CCHO;
③能与NaHCO3反应,说明含有-COOH,分子内含有一个苯环,含有至少七个碳原子,根据相对分子质量为136,说明只能含有一个-COOH,则已经结构中含有七个碳原子和两个氧原子,相对分子质量还差136-7×12-2×16=20,即可得分子中含有八个碳原子、八个氢原子和两个氧原子,分子式为C8H8O2,去除苯环和羧基后,应还有一个甲基或亚甲基,则有机物结构为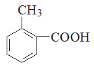 、
、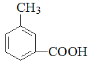 、
、![]() 、
、![]()
其核磁共振氢谱分别有6、6、4、5个峰,则4个峰的有机物结构简式为![]() 。
。

【题目】某学生对Na2SO3与AgNO3在不同pH下的反应进行探究。
(1)测得Na2SO3溶液pH=11,AgNO3溶液pH=5,二者水解的离子分别是 。
(2)调节pH,实验记录如下:
实验 | pH | 现象 |
A | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
B | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
C | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
查阅资料得知:
Ⅰ.Ag2SO3:白色,难溶于水,溶于过量Na2SO3的溶液
Ⅱ.Ag2O:棕黑色,不溶于水,能和酸反应
①推测a中白色沉淀为Ag2SO3,离子方程式是 。
②推测a中白色沉淀为Ag2SO4,推测的依据是 。
(3)取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解。该同学设计实验确认了白色沉淀不是Ag2SO4,实验方法是:另取Ag2SO4固体置于 溶液中,未溶解。
(4)将c中X滤出、洗净,为确认其组成,实验如下:
Ⅰ.向X中滴加稀盐酸,无明显变化
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体
Ⅲ.用Ba(NO3)2溶液、BaCl2溶液检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀
①实验Ⅰ的目的是 。
②根据实验现象,分析X的性质和元素组成是 。
③Ⅱ中反应的化学方程式是 。
(5)该同学综合以上实验,分析产生X的原因,认为随着酸性的增强,还原性增强。通过进一步实验确认了这种可能性,实验如图所示:
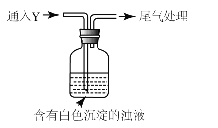
①气体Y是 。
②白色沉淀转化为X的化学方程式是 。