��Ŀ����
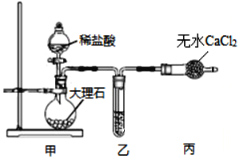
����Ŀ��ij��ɫ��Һ�п��ܺ���Na+��NH4+��Fe2+��Fe3+��Cl����SO42����CO32�������ӣ�������ˮ�ĵ�������ӵ�ˮ�⣩��ijͬѧΪ��ȷ������֣���Ʋ����������ʵ�飺

����˵����ȷ���ǣ� ��
A.c��Fe3+��һ��Ϊ0.2 molL��1
B.c��Cl��������Ϊ0.2 molL��1
C.Na+'��SO42��һ�����ڣ�NH4+һ��������
D.Na+��Fe2+���ܴ��ڣ�CO32��һ��������
���𰸡�D
��������
ij��ɫ��Һ�п��ܺ���Na����NH4����Fe2����Fe3����Cl����SO42����CO32�������ӣ������жϺ�Fe3�����������NaOH��Һ�����ȣ������ĺ��ɫ����Ϊ�������������յõ�1.6g����Ϊ�����������������������ʵ���=1.6g/160g��mol��1=0.01mol����ԭ��Һ�к���0.02mol��Ԫ��ΪFe3����ԭ��Һ��һ��û��CO32����4.66g����������Ĺ���Ϊ���ᱵ�����ᱵ�����ʵ���=4.66g/233g��mol��1=0.02mol��ԭ��Һ�к���0.02mol��������ӣ����ڼ���������������Һ�����ж�ԭ��Һ���Ƿ��������ӣ�����ҺΪ�����Կ��ж��Ƿ���������ӡ�
�������NaOH��Һ�����Ȳ����ĺ��ɫ����Ϊ����������1.6g����Ϊ�����������������������ʵ���Ϊ0.01mol����ԭ��Һ�к���0.02mol��Ԫ��ΪFe3+��ԭ��Һ��һ��û��CO32�������ڼ�����NaOH�����ж�ԭ��Һ���Ƿ���Na+��4.66g����������Ĺ���Ϊ���ᱵ�����ᱵ�����ʵ���Ϊ0.02mol����ԭ��Һ�к���0.02mol��������ӣ��ɵ���غ㣬�����=3n��Fe3+��=0.06�������=2n��SO42����=0.04��ԭ��Һ��һ����Cl�������ʵ���ӦΪ 0.02mol��3��0.02mol��2=0.02mol����������������ʱ��c��Cl��������С��0.2mol/L����Һ��Fe2+���ȱ�����Ҳ�������������ӣ���ԭ��Һ��c��Fe3+��=![]() ��0.2mol/L����Һ��Na+��NH4+��Fe2+���ӿ��ܴ��ڣ�
��0.2mol/L����Һ��Na+��NH4+��Fe2+���ӿ��ܴ��ڣ�
��ѡ��D��

����Ŀ����һ������CO2����ͨ��500 mLij����������Һ�У���ַ�Ӧ����Һ�ڵ������������õ������ᾧˮ�İ�ɫ����A��ȡ������������ͬ��A�����ֱ���50mL��ͬŨ�ȵ�������Һ��Ӧ���õ���״����������������A��������ϵ�����ʾ��
��� | �� | �� | �� |
A������ | 3.80 | 5.70 | 7.60 |
���������mL�� | 896 | 1344 | 1120 |
��1�����жϣ�A�ijɷ�___��
��2���������ʵ���Ũ��Ϊ___molL��1��