题目内容
【题目】按要求填空:
用化学用语回答下列问题:
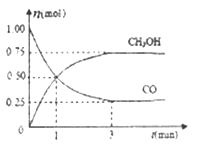
(1)写出二硫化碳分子的电子式:__________
(2)写出氮气分子的结构式:__________
(3)A+、B-、C、D 四种粒子(分子或离子),它们都分别含10个电子,已知它们有如下转化关系:A++B-![]() C+D↑,则A+的电子式:_______;比较C和D的稳定性的强弱:_____(用化学式表示)
C+D↑,则A+的电子式:_______;比较C和D的稳定性的强弱:_____(用化学式表示)
(4)用电子式表示MgCl2的形成过程__________
【答案】![]() N≡N
N≡N ![]() H2O>NH3
H2O>NH3 ![]()
【解析】
(1)二硫化碳分子中碳原子与硫原子之间形成2对共用电子对;
(2)氮气分子中含有1个氮氮三键;
(3)A+、B-、C、D四种粒子(分子或离子),它们都分别含10个电子,且有A++Bˉ![]() C+D↑,则A为铵根离子,B氢氧根离子,C为水,D为氨气,非金属性越强,简单氢化物的稳定性越强;
C+D↑,则A为铵根离子,B氢氧根离子,C为水,D为氨气,非金属性越强,简单氢化物的稳定性越强;
(4)MgCl2是离子化合物,Mg最外层两个电子被两个Cl原子得到。
(1)二硫化碳分子中碳原子与硫原子之间形成2对共用电子对,电子式为![]() ;
;
(2)氮气分子中含有氮氮三键,其结构式为:N≡N;
(3)A+、B-、C、D四种粒子(分子或离子),它们都分别含10个电子,且有A++Bˉ![]() C+D↑,则A为铵根离子,B氢氧根离子,C为水,D为氨气,铵根离子含有四个N-H键,即N与H共用4 对电子,所以电子式为
C+D↑,则A为铵根离子,B氢氧根离子,C为水,D为氨气,铵根离子含有四个N-H键,即N与H共用4 对电子,所以电子式为![]() ,N、O位于第二周期,O的非金属性强,所以水比氨气稳定,即稳定性H2O>NH3;
,N、O位于第二周期,O的非金属性强,所以水比氨气稳定,即稳定性H2O>NH3;
(4)MgCl2属于离子化合物,Mg最外层两个电子被两个Cl原子得到,用电子式表示形成过程为:![]() 。
。

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目