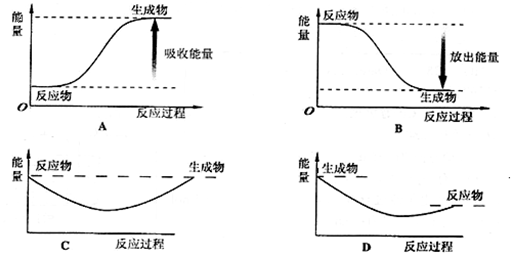
题目内容
已知:H+ (aq)+OH- (aq)= H2O △H1 =" -" 57.3 kJ·mol-1,
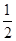 H2SO4(浓)+ NaOH(aq)=
H2SO4(浓)+ NaOH(aq)=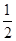 Na2SO4(aq)+ H2O(l) △H2 = m,下列说法正确的是( )
Na2SO4(aq)+ H2O(l) △H2 = m,下列说法正确的是( )
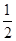 H2SO4(浓)+ NaOH(aq)=
H2SO4(浓)+ NaOH(aq)=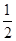 Na2SO4(aq)+ H2O(l) △H2 = m,下列说法正确的是( )
Na2SO4(aq)+ H2O(l) △H2 = m,下列说法正确的是( )| A.上述热化学方程式中的计量数表示分子个数 | B.△H1>△H2 |
| C.△H2 =" -" 57.3 kJ·mol-1 | D.|△H1|>|△H2| |
B
【错解分析】此题旨在考查对“热化学方程式的意义”的理解和对“中和热”概念的掌握,属于容易题。
【正解】热化学方程式中的化学计量数表示物质的量,A项不对;浓H2SO4在稀释时放热,含0.5 mol H2SO4的浓H2SO4与1 mol NaOH反应放出的热量应等于浓硫酸稀释时放出的热量和中和热之和,因此,△H2 < △H1 < 0,且|△H1| > |△H2|。

练习册系列答案
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
 FeO(s)+CO(g) △H1=" a" kJ·mol-1
FeO(s)+CO(g) △H1=" a" kJ·mol-1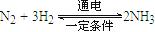 。则在电解法合成氨的过程中,应将H2不断地通入 极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为 。
。则在电解法合成氨的过程中,应将H2不断地通入 极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为 。 O2(气)=CO(气); △H ="-393.5" kJ/mol
O2(气)=CO(气); △H ="-393.5" kJ/mol 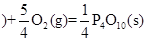 △H = —738.5kJ?mol-1
△H = —738.5kJ?mol-1