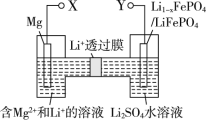
题目内容
【题目】钼酸钠(Na2MoO4)是一种冷却水系统的金属缓蚀剂,工业上利用钼精矿(主要成分为MoS2)制备金属钼和钼酸钠晶体的流程如下图所示。
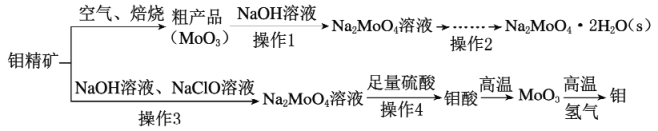
回答下列问题:
(1)如果在空气中焙烧1mol MoS2时,S转移12mol电子,则MoS2中钼元素的化合价为_________;焙烧的产物除MoO3外的另一种是_________,产生的尾气对环境的主要危害是____________________________。
(2)若在实验室中进行操作2,则从钼酸钠溶液中得到钼酸钠晶体的操作步骤是____________________,过滤、洗涤、干燥。
(3)钼精矿中MoS2含量的测定:取钼精矿16g,经在空气中焙烧、操作1、操作2得到钼酸钠晶体(Na2MoO4·2H2O)12.1g,钼精矿中MoS2的质量分数为_________________________。(已知MoS2的相对分子质量为160,Na2MoO4·2H2O的相对分子质量为242)。
(4)操作3发生反应的离子方程式为__________________________________________________。
(5)用镍、钼作电极电解浓NaOH溶液制备钼酸钠(Na2MoO4)的装置如图甲所示。b电极的材料为_______(填“镍”或“钼”),其电极反应式为_________________________________________________。
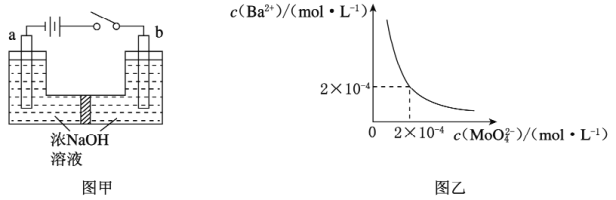
(6)某温度下,BaMoO4在水中的沉淀溶解平衡曲线如图乙所示,该温度下BaMoO4的Ksp为____________。
【答案】+4 SO2 形成酸雨 加热浓缩(或蒸发浓缩)、冷却结晶 50% MoS2 + 6OH- + 9ClO- =MoO42— + 2SO42— + 9Cl— + 3H2O 钼 Mo - 6e- + 8OH— = MoO42— + 4H2O 4×10-8
【解析】
灼烧钼精矿,MoS2燃烧,反应方程式为2MoS2+7O2 ![]() 2MoO3+4SO2,碱性条件下,MoO3和NaOH溶液反应,反应方程式为MoO3+2OH-=MoO42-+H2O,操作1是过滤,溶液中的溶质为Na2MoO4,操作2是将溶液蒸发浓缩、冷却结晶,然后重结晶得到Na2MoO4.2H2O;钼精矿,碱溶并用NaClO氧化,操作3,过滤也得到Na2MoO4与足量硫酸反应生成钼酸,高温灼烧钼酸生成MoO3,氢气还原MoO3得到Mo。
2MoO3+4SO2,碱性条件下,MoO3和NaOH溶液反应,反应方程式为MoO3+2OH-=MoO42-+H2O,操作1是过滤,溶液中的溶质为Na2MoO4,操作2是将溶液蒸发浓缩、冷却结晶,然后重结晶得到Na2MoO4.2H2O;钼精矿,碱溶并用NaClO氧化,操作3,过滤也得到Na2MoO4与足量硫酸反应生成钼酸,高温灼烧钼酸生成MoO3,氢气还原MoO3得到Mo。
(1)如果在空气中焙烧1mol MoS2时,S转移12mol电子,根据电子守恒:(+4-x)×2=12,x=-2,则MoS2中硫元素为-2价,钼元素的化合价为+4;焙烧的产物除MoO3外的另一种是SO2,产生的尾气对环境的主要危害是形成酸雨。故答案为:+4;SO2;形成酸雨;
(2)在实验室中进行操作2,从钼酸钠溶液中得到钼酸钠晶体的操作步骤是加热浓缩(或蒸发浓缩)、冷却结晶,过滤、洗涤、干燥。故答案为:加热浓缩(或蒸发浓缩)、冷却结晶;
(3)由关系式
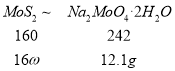
160:16ω=242:12.1g,ω=0.5,钼精矿中MoS2的质量分数为50%。故答案为:50%;
(4)操作3在碱性条件下,NaClO将MoS2 氧化生成MoO42— 和SO42—,发生反应的离子方程式为MoS2 + 6OH- + 9ClO- =MoO42— + 2SO42— + 9Cl— + 3H2O。故答案为:MoS2 + 6OH- + 9ClO- =MoO42— + 2SO42— + 9Cl— + 3H2O;
(5)b与电源正极相连,为阳极,b电极的材料为钼发生氧化反应,其电极反应式为Mo - 6e- + 8OH— = MoO42— + 4H2O。故答案为:钼;Mo - 6e- + 8OH— = MoO42— + 4H2O;
(6)由图乙:某温度下,BaMoO4的Ksp为c(Ba2+)c(MoO42-)==2×10-4×2×10-4= 4×10-8。故答案为:4×10-8。

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案【题目】研究NOx、CO、SO2等大气污染气体的治理,对保护环境有重要的意义。回答下列问题:
(1)NOx与CO反应生成无污染气体的相关热化学方程式如下:
①NO2(g)+CO(g)![]() CO2(g)+NO(g) ΔH1=234.0kJ·mol1
CO2(g)+NO(g) ΔH1=234.0kJ·mol1
②4NO(g)![]() 2NO2(g)+N2(g) ΔH2=291.8kJ·mol1
2NO2(g)+N2(g) ΔH2=291.8kJ·mol1
反应③2NO2(g)+4CO(g)![]() N2(g)+4CO2(g)的ΔH3=___kJ·mol1,有利于提高该反应NO2平衡转化率的条件是___(填标号)。
N2(g)+4CO2(g)的ΔH3=___kJ·mol1,有利于提高该反应NO2平衡转化率的条件是___(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
(2)在一定温度下,向2L的恒容密闭容器中充入4.0molNO2和4.0molCO,在催化剂作用下发生反应:2NO2(g)+4CO(g)![]() N2(g)+4CO2(g),测得相关数据如下:
N2(g)+4CO2(g),测得相关数据如下:
0min | 5min | 10min | 15min | 20min | |
c(NO2)/mol·L1 | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
c(N2)/mol·L1 | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
①其他条件不变,若不使用催化剂,则0~5minNO2的转化率将___(填“变大”、“变小”或“不变”)。
②以下表述能说明该反应已达到平衡状态的是___。
A.CO的反应速率为N2的4倍
B.气体的颜色不再变化
C.化学平衡常数K不再变化
D.混合气的压强不再变化
③该温度下反应的化学平衡常数K=__(保留两位有效数字)。
④在20min时,保持温度不变,继续向容器中再加入2.0molNO2和2.0molN2,则化学平衡__移动(填“正向”、“逆向”或“不”)。
(3)在高效催化剂的作用下用CH4还原NO2,也可消除氮氧化物的污染。
①CH4还原NO2反应的化学方程式为___。
②在相同条件下,选用A、B、C三种不同催化剂进行反应,生成N2的物质的量与时间变化如图图1所示,其中活化能最大的是___[Ea(A)、Ea(B)、Ea(C)分别表示三种催化剂下该反应的活化能]。
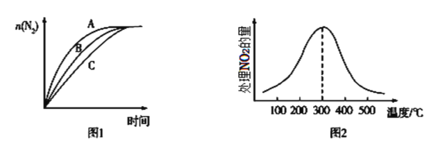
③在催化剂A作用下,测得相同时间内处理NO2的量与温度的关系如图2所示,曲线先增大后减小的可能原因是___。