题目内容
【题目】如图为周期表的一部分,表中所列的字母分别代表一种化学元素。回答下列问题:
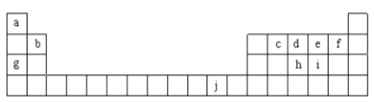
(1)f的基态原子核外电子排布式______。
(2)在c2a4分子中,c为______杂化,c与c间存在的共价键类型有______两种。
(3)ci2与ce2比较,沸点较高的是______(写分子式)。
(4)将氨水滴入到j的硫酸盐溶液中,先产生蓝色沉淀,然后沉淀逐渐溶解并得到深蓝色溶液。深蓝色溶液中是由于存在______(写结构式)
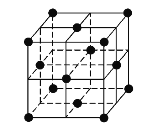
(5)j的金属晶体的晶胞如图所示,则一个晶胞中每个j原子周围与它最接近且距离相等的j共有的个数是______个,已知该元素的相对原子质量为64,单质晶体的密度为ρgcm-3,阿伏加德罗常数的值为NA,试求铜的金属半径为______pm(用含NA、ρ的表达式表达)。
【答案】1s22s22p5 sp2 σ 和π CS2 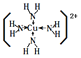 12
12 ![]()
【解析】
(1)f为F原子,核外有9个电子,基态原子核外电子排布式为1s22s22p5 ,故答案为:1s22s22p5 ;
(2)c为C,a为H,则c2a4为C2H4,乙烯为平面结构,分子中,c为sp2杂化,c与c间为碳碳双键,共价键类型有 σ 和π两种,
故答案为:sp2;σ 和π;
(3)c为C,i为S,e为O,则ci2与ce2分别为CS2与CO2,组成和结构相似的分子,相对分子质量越大,分子间作用力越大,沸点越高,所以沸点较高的是CS2,故答案为:CS2;
(4)j为Cu,将氨水滴入到硫酸铜溶液中,铜离子存在空轨道,和氨气分子通过形成配位键形成铜氨离子,所以深蓝色溶液中是由于存在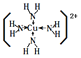 ,
,
故答案为: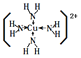 ;
;
(5)由晶胞结构示意图可知,铜的晶胞为面心立方最密堆积,配位数是12,即每个铜原子周围与它最接近且距离相等的铜原子共有12个;晶胞中顶点的原子属于该晶胞只有1/8,面心的原子属于该晶胞只有1/2,则该晶胞中所含原子数为8×1/8+6×1/2=4,取1mol晶胞,即有NA个晶胞,设晶胞边长为acm,1个晶胞中含有Cu的体积为V=a3cm3,则晶体密度为ρ=![]() g/cm3,根据几何关系,Cu的半径与晶胞边长之间关系为:
g/cm3,根据几何关系,Cu的半径与晶胞边长之间关系为:![]() =4r,所以a=2
=4r,所以a=2![]() r,则r=
r,则r=![]() 。
。
故答案为:12 ; ![]() 。
。

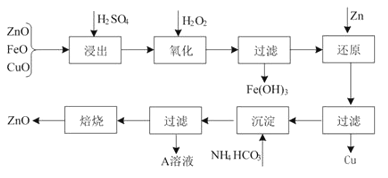
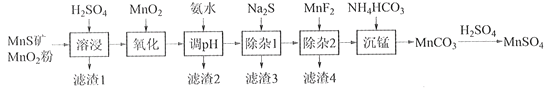
【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
相关金属离子[c0(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和__________________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式____________________________________________________。
(2)“氧化”中添加适量的MnO2的作用是将________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_____________________________________________________________________。
(6)写出“沉锰”的离子方程式___________________________________________________。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnz2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=![]() 时,z=___________。
时,z=___________。