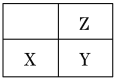
题目内容
【题目】请利用下列装置及试剂组装一套装置,其流程是先制取纯净干燥的Cl2(不收集),后验证干燥的Cl2和潮湿的Cl2有无漂白性。按气体从左向右流向将各装置依次连接起来: a 接i,j接g,f接e,d接b,c接h,试回答:

(1)F装置中的试剂应为:_________,作用是_______________________。
(2)A装置中的主要玻璃仪器有:酒精灯、圆底烧瓶、________________。
(3)A装置中发生反应的化学方程式是_______________________________。
(4)E装置中发生反应的离子反应方程式是_______________________________。
【答案】饱和食盐水 吸收氯化氢气体 分液漏斗 MnO2+4HCl(浓)![]() MnCl2+Cl2↑ +2H2O Cl2+2OH- = Cl- + ClO- + H2O
MnCl2+Cl2↑ +2H2O Cl2+2OH- = Cl- + ClO- + H2O
【解析】
(1)装置A制备氯气,氯气中含有HCl和水蒸气,根据实验目的,即F装置中盛放饱和食盐水,作用是吸收氯化氢气体;
(2)根据装置图,使用的玻璃仪器是酒精灯、圆底烧瓶、分液漏斗;
(3)发生反应的方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(4)E的作用是吸收过量的氯气,防止污染空气,发生的离子反应方程式为Cl2+2OH-=Cl-+ClO-+H2O。

 寒假学与练系列答案
寒假学与练系列答案【题目】硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3、MgO、CaO等,生产工艺流程示意如下:
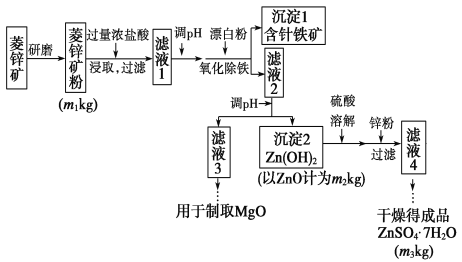
(1)完成“氧化除铁”步骤中反应的离子方程式:
(_________)Fe(OH)2+(________)________+(_________)______===(________)Fe(OH)3+(_________)Cl-
(2)针铁矿(Coethite)是以德国诗人歌德(Coethe)名字命名的,组成元素是Fe、O和H,相对分子质量为89,化学式是________。
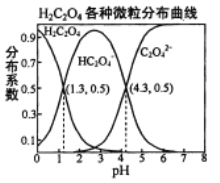
(3)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为___。
Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
开始沉淀的pH | 10.4 | 6.4 | — | — |
沉淀完全的pH | 12.4 | 8.0 | — | — |
开始溶解的pH | — | 10.5 | — | — |
Ksp mol3·L-3 | 5.6×10-12 | — | 6.8×10-10 | 2.8×10-9 |
(4)工业上从“滤液3”制取MgO过程中,合适的反应物是________(选填序号)。
a.大理石粉 b.石灰粉 c.纯碱溶液 d.烧碱溶液
(5)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于________________。