题目内容
在容积一定的密闭容器中,反应A(g)+2B(g) 2C(g)达平衡,设初始A、B的物质的量分别为Xmol、Ymol,若要使平衡时反应物总物质的量与生成物总物质的量相等,则X/Y应满足的是
2C(g)达平衡,设初始A、B的物质的量分别为Xmol、Ymol,若要使平衡时反应物总物质的量与生成物总物质的量相等,则X/Y应满足的是
A.1 <X/Y<3 B.3< X/Y <4
C.0.25< X/Y <1.5 D.0.25< X/Y <0.5
 2C(g)达平衡,设初始A、B的物质的量分别为Xmol、Ymol,若要使平衡时反应物总物质的量与生成物总物质的量相等,则X/Y应满足的是
2C(g)达平衡,设初始A、B的物质的量分别为Xmol、Ymol,若要使平衡时反应物总物质的量与生成物总物质的量相等,则X/Y应满足的是 A.1 <X/Y<3 B.3< X/Y <4
C.0.25< X/Y <1.5 D.0.25< X/Y <0.5
C
试题分析:令参加反应的X的物质的量为n,
X(g)+2Y(g)
 2Z(g),
2Z(g),开始(mol):x y 0
转化(mol):n 2n 2n
平衡(mol):x-n y-2n 2n
平衡时反应物总物质的量与生成物总物质的量相等,所以有x-n+y-2n=2n,解得n=(X+Y)/5;
反应物不能完全反应,所以有x>n,y>2n,即x>(X+Y)/5 (1),y>2(X+Y)/5 (2)
解(1)得:X/Y>1/4
解(2)得:X/Y<3/2
所以1/4<X/Y<3/2。即0.25< X/Y <1.5。
故选C。
点评:本题考查的是化学平衡的综合应用能力极值法的应用。难度稍难。关键在于利用反应物不能完全反应,列不等式。

练习册系列答案
相关题目
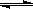 2/3Fe (s)+CO2(g),已知该反应在不同温度下的平衡常数如下。则:
2/3Fe (s)+CO2(g),已知该反应在不同温度下的平衡常数如下。则:
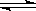 2NH3已达到平衡状态 ( )
2NH3已达到平衡状态 ( ) 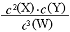
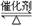 2SO3(g) ΔH<0。某温度下,将2 mol SO2和
2SO3(g) ΔH<0。某温度下,将2 mol SO2和
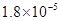 ,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Kap(CaF2)=
,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Kap(CaF2)=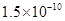
 mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:
mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:

 mol·L-1HF溶液与
mol·L-1HF溶液与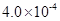 mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化), (填“有”或“无”)沉淀产生。
mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化), (填“有”或“无”)沉淀产生。 Fe(s)+ CO2(g) ΔH>0。已知1100℃时,K=0.26
Fe(s)+ CO2(g) ΔH>0。已知1100℃时,K=0.26