ĢāÄæÄŚČŻ
”¾ĢāÄæ”æŅŃÖŖ“×ĖįŗĶŃĪĖįŹĒČÕ³£Éś»īÖŠ¼«ĪŖ³£¼ūµÄĖį£¬ŌŚŅ»¶ØĢõ¼žĻĀ£¬CH3COOHČÜŅŗÖŠ“ęŌŚµēĄėĘ½ŗā£ŗCH3COOH![]() CH3COO+H+ ¦¤H£¾0”£
CH3COO+H+ ¦¤H£¾0”£
£Ø1£©³£ĪĀ³£Ń¹ĻĀ£¬ŌŚpH=5µÄĻ”“×ĖįČÜŅŗÖŠ£¬c(CH3COO£©=__£»£Ø¾«Č·Öµ£©ĻĀĮŠ·½·ØÖŠ£¬æÉŅŌŹ¹0.10mol”¤L£1CH3COOHµÄµēĄė³Ģ¶ČŌö“óµÄŹĒ___”£
a.¼ÓČėÉŁĮæ0.10mol”¤L1µÄĻ”ŃĪĖį b.¼ÓČČCH3COOHČÜŅŗ c.¼ÓČėÉŁĮæ±ł“×Ėį d.¼ÓĖ®Ļ”ŹĶÖĮ0.010mol”¤L£1 e.¼ÓČėÉŁĮæĀČ»ÆÄĘ¹ĢĢå f.¼ÓČėÉŁĮæ0.10mol”¤L£1µÄNaOHČÜŅŗ
£Ø2£©ŅŃÖŖ£ŗ90”ꏱ£¬Ė®µÄĄė×Ó»ż³£ŹżĪŖKw=38”Į10£14£¬ŌŚ“ĖĪĀ¶ČĻĀ£¬½«pH=3µÄŃĪĖįŗĶpH=11µÄĒāŃõ»ÆÄĘČÜŅŗµČĢå»ż»ģŗĻ£¬Ōņ»ģŗĻČÜŅŗÖŠµÄc(H+)=___£Ø±£ĮōČżĪ»ÓŠŠ§Źż×Ö£©”£
£Ø3£©ĻÖÓŠÅØ¶Č¾łĪŖ0.1mol/LµÄĻĀĮŠČÜŅŗ£ŗ¢ŁĮņĖį ¢Ś“×Ėį ¢ŪĒāŃõ»ÆÄĘ ¢ÜĀČ»Æļ§ ¢Ż“×Ėįļ§ ¢ŽĮņĖįļ§ ¢ßĮņĖįĒāļ§ ¢ą°±Ė®£¬Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
¢”.¢Ł”¢¢Ś”¢¢Ū”¢¢ÜĖÄÖÖČÜŅŗÖŠÓÉĖ®µēĄė³öµÄH£«µÄÅضČÓɓ󵽊”µÄĖ³ŠņŹĒ(ĢīŠņŗÅ)__”£
¢¢.¢Ü”¢¢Ż”¢¢Ž”¢¢ß”¢¢ąĪåÖÖČÜŅŗÖŠNH4+ÅضČÓɓ󵽊”µÄĖ³ŠņŹĒ(ĢīŠņŗÅ)___”£
£Ø4£©Ņ»¶ØĢõ¼žĻĀ¼×“¼ÓėŅ»Ńõ»ÆĢ¼·“Ó¦æÉŅŌŗĻ³ÉŅŅĖį”£³£ĪĀĢõ¼žĻĀ£¬½«a mol/LµÄCH3COOHÓėb mol/LBa£ØOH£©2ČÜŅŗµČĢå»ż»ģŗĻ£¬·“Ó¦Ę½ŗāŹ±£¬2c£ØBa2+£©=c£ØCH3COO-£©£¬ÓĆŗ¬aŗĶbµÄ“śŹżŹ½±ķŹ¾øĆ»ģŗĻČÜŅŗÖŠ“×ĖįµÄµēĄė³£ŹżĪŖ___”£
”¾“š°ø”æ£Ø10£5£10£9£©mol”¤L£1 bdf 2.05”Į10£11mol”¤L-1 ¢Ü¢Ś¢Ū¢Ł ¢Ž¢ß¢Ü¢Ż¢ą ![]()
”¾½āĪö”æ
£Ø1£©ČÜŅŗÖŠH£«°üĄØ“×ĖįµēĄė²śÉśµÄ»¹ÓŠĖ®µēĄė²śÉśµÄ”£øł¾ŻĖ®µÄĄė×Ó»żæÉÖŖ£¬Ė®µēĄė²śÉśµÄc£ØH£«£©=c£ØOH££©=![]() =10£9mol”¤L£1£¬Ņņ“Ė“×ĖįµēĄė²śÉśµÄc£ØH£«£©=c£ØCH3COO££©=£Ø10£5£10£9£©mol”¤L£1£»“×Ėį“ęŌŚµÄµēĄėĘ½ŗāĪŖCH3COOH
=10£9mol”¤L£1£¬Ņņ“Ė“×ĖįµēĄė²śÉśµÄc£ØH£«£©=c£ØCH3COO££©=£Ø10£5£10£9£©mol”¤L£1£»“×Ėį“ęŌŚµÄµēĄėĘ½ŗāĪŖCH3COOH![]() CH3COO££«H£«£¬Ōņ
CH3COO££«H£«£¬Ōņ
a”¢¼ÓČėŃĪĖįŌö“óĮĖČÜŅŗc(H£«)£¬¶Ō“×ĖįµÄµēĄėĘšŅÖÖĘ×÷ÓĆ£¬a“ķĪó£»
b”¢Čõµē½āÖŹµÄµēĄėŹĒĪüČČ·“Ó¦£¬ÉżøßĪĀ¶Č£¬ÓŠĄūÓŚĻņµēĄė·½Ļņ½ųŠŠ£¬bÕżČ·£»
c”¢¼ÓČė±ł“×Ėį£¬µēĄė³Ģ¶Č½µµĶ£¬c“ķĪó£»
d”¢¼ÓĖ®Ļ”ŹĶ£¬½µµĶĮĖÅØ¶Č£¬øł¾ŻĄÕĻÄĢŲĮŠŌĄķ£¬Ę½ŗāĻņÅضČŌö“óµÄ·½Ļņ½ųŠŠ£¬¼“ĻņµēĄė·½Ļņ½ųŠŠ£¬dÕżČ·£»
e”¢¼ÓČėĀČ»ÆÄĘ¹ĢĢ壬¶ŌµēĄėĪŽÓ°Ļģ£¬e“ķĪó£»
f”¢¼ÓČėĒāŃõ»ÆÄĘ£¬ĻūŗÄH£«£¬“ŁŹ¹Ę½ŗāĻņµēĄė·½Ļņ½ųŠŠ£¬fÕżČ·£¬¹Ź“š°øŃ”bdf£»
£Ø2£©pH=3µÄŃĪĖįÖŠc£ØH+£©=10-3mol/L£¬pH=11µÄĒāŃõ»ÆÄĘČÜŅŗÖŠc£ØOH-£©=![]() =38”Į10-3mol/L£¬»ģŗĻŗó£ŗH++OH-=H2O£¬ĖłŅŌ¼īŹ£Óą£¬Ź£ÓąµÄĒāŃõøłµÄÅضČĪŖc£ØOH-£©=
=38”Į10-3mol/L£¬»ģŗĻŗó£ŗH++OH-=H2O£¬ĖłŅŌ¼īŹ£Óą£¬Ź£ÓąµÄĒāŃõøłµÄÅضČĪŖc£ØOH-£©=![]() =0.0185mol/L£¬ĖłŅŌc£ØH+£©=
=0.0185mol/L£¬ĖłŅŌc£ØH+£©=![]() ”Ö2.05”Į10-11 mol”¤L-1£»
”Ö2.05”Į10-11 mol”¤L-1£»
£Ø3£©¢”.ĮņĖįŗĶ“×Ėį”¢ĒāŃõ»ÆÄĘ¾łŅÖÖĘĖ®µÄµēĄė£¬µČÅØ¶ČµÄĮņĖįŗĶ“×Ėį”¢ĒāŃõ»ÆÄĘŌŚČÜŅŗÖŠµēĄė³öµÄH+»ņOH-ÅØ¶Č“óŠ”¹ŲĻµ£ŗH2SO4£¾NaOH£¾CH3COOH£¬Ņņ“Ė¶ŌĖ®µÄµēĄėŅÖÖĘ×÷ÓĆĒæČõ¹ŲĻµĪŖ£ŗH2SO4£¾NaOH£¾CH3COOH£¬ŌņĖ®µēĄė³öĄ“µÄH+ÅØ¶Č“óŠ”¹ŲĻµ£ŗCH3COOH£¾NaOH£¾H2SO4£¬ÓÖŅņĪŖNH4ClÄܹ»Ė®½ā£¬¶ŌĖ®µÄµēĄėĘš“Ł½ų×÷ÓĆ£¬ĖłŅŌĖÄÖÖČÜŅŗÖŠÓÉĖ®µēĄė³öµÄH+ÅضČÓɓ󵽊”µÄĖ³Šņ£ŗNH4Cl£¾CH3COOH£¾NaOH£¾H2SO4£¬¼“¢Ü¢Ś¢Ū¢Ł”£
¢¢.ĀČ»Æļ§ŗĶĮņĖįļ§ČÜŅŗÖŠ“ęŌŚ×ÅNH4Cl=NH4++Cl-£¬NH4++H2O![]() NH3
NH3![]() H2O+H+£¬“×Ėįļ§ČÜŅŗÖŠCH3COONH4=CH3COO-+NH4+£¬CH3COO-+H2O
H2O+H+£¬“×Ėįļ§ČÜŅŗÖŠCH3COONH4=CH3COO-+NH4+£¬CH3COO-+H2O![]() CH3COOH+OH-£¬NH4++H2O
CH3COOH+OH-£¬NH4++H2O![]() NH3
NH3![]() H2O+H+£»ĮņĖįĒāļ§ČÜŅŗÖŠNH4HSO4=NH4++H++SO42-£¬NH4++H2O
H2O+H+£»ĮņĖįĒāļ§ČÜŅŗÖŠNH4HSO4=NH4++H++SO42-£¬NH4++H2O![]() NH3
NH3![]() H2O+H+£»°±Ė®ÖŠNH3
H2O+H+£»°±Ė®ÖŠNH3![]() H2O
H2O![]() NH4++OH-£¬µČÅØ¶ČµÄĪåÖÖČÜÖŹ£¬ĮņĖįļ§ÖŠNH4+µÄ³õŹ¼ÅضČ×ī“ó£¬ĀČ»Æļ§ČÜŅŗ”¢“×Ėįļ§ČÜŅŗ”¢ĮņĖįĒāļ§ČÜŅŗÖŠNH4+µÄ³õŹ¼ÅضČĻąĶ¬£¬“×Ėįļ§ÖŠCH3COO-Ė®½āÉś³ÉµÄOH-¶ŌNH4+µÄĖ®½āĘš“Ł½ų×÷ÓĆ£¬ĮņĖįĒāļ§ÖŠH+¶ŌNH4+µÄĖ®½āĘšŅÖÖĘ×÷ÓĆ£¬¹ŹČżÕßÖ®¼äNH4+ÅØ¶Č“óŠ”ĪŖ£ŗNH4HSO4£¾NH4Cl£¾CH3COONH4£¬ÓÖŅņĪŖ°±Ė®Ö»Äܲæ·ÖµēĄė£¬ŌŚÕāĖÄÖÖČÜŅŗÖŠŗ¬ÓŠµÄNH4+ÅضČ×īŠ”£¬ĖłŅŌÉĻŹöĪåÖÖČÜŅŗÖŠNH4+ÅضČÓɓ󵽊”µÄĖ³ŠņŹĒ£ŗ¢Ž¢ß¢Ü¢Ż¢ą£»
NH4++OH-£¬µČÅØ¶ČµÄĪåÖÖČÜÖŹ£¬ĮņĖįļ§ÖŠNH4+µÄ³õŹ¼ÅضČ×ī“ó£¬ĀČ»Æļ§ČÜŅŗ”¢“×Ėįļ§ČÜŅŗ”¢ĮņĖįĒāļ§ČÜŅŗÖŠNH4+µÄ³õŹ¼ÅضČĻąĶ¬£¬“×Ėįļ§ÖŠCH3COO-Ė®½āÉś³ÉµÄOH-¶ŌNH4+µÄĖ®½āĘš“Ł½ų×÷ÓĆ£¬ĮņĖįĒāļ§ÖŠH+¶ŌNH4+µÄĖ®½āĘšŅÖÖĘ×÷ÓĆ£¬¹ŹČżÕßÖ®¼äNH4+ÅØ¶Č“óŠ”ĪŖ£ŗNH4HSO4£¾NH4Cl£¾CH3COONH4£¬ÓÖŅņĪŖ°±Ė®Ö»Äܲæ·ÖµēĄė£¬ŌŚÕāĖÄÖÖČÜŅŗÖŠŗ¬ÓŠµÄNH4+ÅضČ×īŠ”£¬ĖłŅŌÉĻŹöĪåÖÖČÜŅŗÖŠNH4+ÅضČÓɓ󵽊”µÄĖ³ŠņŹĒ£ŗ¢Ž¢ß¢Ü¢Ż¢ą£»
£Ø4£©³£ĪĀĢõ¼žĻĀ£¬½«a mol/LµÄCH3COOHÓėb mol/L Ba(OH)2ČÜŅŗµČĢå»ż»ģŗĻ£¬øł¾ŻČÜŅŗ³ŹĻÖµēÖŠŠŌ£ŗ2c(Ba2£«)+c(H+)£½c(CH3COO£)+c(OH”Ŗ)£¬ÓÖ2c(Ba2£«)£½c(CH3COO£)£½b mol/L£¬ŌņČÜŅŗ³ŹĻÖÖŠŠŌ£¬¼“c(H+)=c(OH”Ŗ)=1”Į10-7mol/L£¬øł¾Ż“×ĖįÓėĒāŃõ»Æ±µČÜŅŗ·“Ó¦µÄ»Æѧ·½³ĢŹ½Č·¶Ø»ģŗĻŅŗÖŠc(CH3COOH)=![]() mol/L£¬øĆ»ģŗĻČÜŅŗÖŠ“×ĖįµÄµēĄė³£ŹżĪŖ
mol/L£¬øĆ»ģŗĻČÜŅŗÖŠ“×ĖįµÄµēĄė³£ŹżĪŖ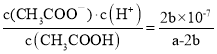 ”£
ӣ

 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø”¾ĢāÄæ”æ¢ń£®µŖµÄ¹Ģ¶ØŹĒ¼ø°ŁÄźĄ“æĘѧ¼ŅŅ»Ö±ŃŠ¾æµÄæĪĢā”£
£Ø1£©ĻĀ±ķĮŠ¾ŁĮĖ²»Ķ¬ĪĀ¶ČĻĀ“óĘų¹ĢµŖŗĶ¹¤Ņµ¹ĢµŖµÄ²æ·ÖKÖµ”£
·“Ó¦ | “óĘų¹ĢµŖ N2£Øg£©£«O2£Øg£© | ¹¤Ņµ¹ĢµŖ N2£Øg£©£«3H2£Øg£© | |||
ĪĀ¶Č/”ę | 27 | 2000 | 25 | 400 | 450 |
K | 3.8”Į10©31 | 0.1 | 5”Į108 | 0.507 | 0.152 |
¢Ł·ÖĪöŹż¾ŻæÉÖŖ£ŗ“óĘų¹ĢµŖ·“Ó¦ŹōÓŚ_____£ØĢī”°ĪüČČ”±»ņ”°·ÅČČ”±£©·“Ó¦”£
¢Ś·ÖĪöŹż¾ŻæÉÖŖ£»ČĖĄą²»ŹŹŗĻ“ó¹ęģģÄā“óĘų¹ĢµŖµÄŌŅņ__________________________”£
£Ø2£©¹¤Ņµ¹ĢµŖ·“Ó¦ÖŠ£¬ŌŚĘäĖūĢõ¼žĻąĶ¬Ź±£¬·Ö±š²ā¶ØN2µÄĘ½ŗā×Ŗ»ÆĀŹŌŚ²»Ķ¬Ń¹Ēæ£ØP1”¢P2£©ĻĀĖęĪĀ¶Č±ä»ÆµÄĒśĻߣ¬ČēĶ¼ĖłŹ¾µÄĶ¼Ź¾ÖŠ£¬ÕżČ·µÄŹĒ___£ØĢī”°A”±»ņ”°B”±£©£»±Č½ĻP1”¢P2µÄ“󊔹ŲĻµ£ŗP1______P2(Ģī”°£¾”±”¢”°£½”± »ņ”°£¼”±)”£

¢ņ£® ÄæĒ°¹¤ŅµŗĻ³É°±µÄŌĄķŹĒ£ŗN2£Øg£©+3H2£Øg£©![]() 2NH3£Øg£©
2NH3£Øg£©
£Ø3£©ŌŚŅ»¶ØĪĀ¶ČĻĀ£¬½«1mol N2ŗĶ3mol H2»ģŗĻÖĆÓŚĢå»ż²»±äµÄĆܱÕČŻĘ÷ÖŠ·¢Éś·“Ó¦£¬“ļµ½Ę½ŗāדĢ¬Ź±£¬²āµĆĘųĢå×ÜĪļÖŹµÄĮæĪŖ2.8mol”£“ļĘ½ŗāŹ±£¬H2µÄ×Ŗ»ÆĀŹ¦Į1£½____”£
”¾ĢāÄæ”æĮŖŗĻ¹ś“ó»į½«2019Äź¶ØĪŖ”°»ÆѧŌŖĖŲÖÜĘŚ±ķ¹ś¼ŹÄź”±£¬ĻŌŹ¾ĮĖŌŖĖŲÖÜĘŚĀɵÄÖŲŅŖŠŌ”£ĻĀ±ķĮŠ³öĮĖa~j10ÖÖŌŖĖŲŌŚÖÜĘŚ±ķÖŠµÄĪ»ÖĆ£ŗ
ÖÜĘŚ | IA | 0 | |||||||
1 | a | IIA | ” | IIIA | IVA | VA | VIA | VIIA | |
2 | b | ” | e | d | |||||
3 | c | f | ” | g | h | i | j |
(1)ŅņŌŚŌŖĖŲbµÄµē³Ų²ÄĮĻĮģÓņ×ö³öĮĖ½Ü³ö¹±Ļ×£¬97ĖźµÄ¹ÅµĻÄÉ·ņČŁ»ń2019ÄźÅµ±“¶ū»Æѧ½±£¬bŌ×Ó½į¹¹Ź¾ŅāĶ¼ĪŖ____£»“ĖĄąµē³Ų¹¤×÷Ź±£¬½«___ÄÜ×Ŗ»ÆĪŖµēÄÜ”£
(2)a~j10ÖÖŌŖĖŲÖŠ£¬×īĶā²ćµē×ÓŹż±ČK²ćµē×ÓŹż¶ąµÄŌŖĖŲÓŠ___ÖÖ(ĢīŹż×Ö)£»½šŹōŠŌ×īĒæµÄŌŖĖŲÓŠ_____(Š“ŌŖĖŲ·ūŗÅ)”£
(3)ŌŖĖŲgµÄ×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦µÄĖ®»ÆĪļÓėNaOHČÜŅŗ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗ_______£»
(4)h”¢i”¢jČżÖÖŌŖĖŲµÄĘųĢ¬Ēā»ÆĪļÖŠ£¬×īĪČ¶ØµÄĒā»ÆĪļŹĒ______(Š“»ÆѧŹ½)£»
(5)ŌŖĖŲiµÄŅ»ÖÖŃõ»ÆĪļ³£ÓĆÓŚĘÆ°×Ö½½¬”¢²ŻĆ±±čµČ”£øĆŃõ»ÆĪļ¾ßÓŠ»¹ŌŠŌ£¬ŌŚŅ»¶ØĢõ¼žĻĀÄÜÓė³£¼ūŃõ»Æ¼Į·¢Éś·“Ó¦£¬Š“³öĘäÖŠŅ»øö·“Ó¦µÄ»Æѧ·½³ĢŹ½£ŗ_______ ”£
”¾ĢāÄæ”æI£®øł¾Ż±ķøńŠÅĻ¢£¬Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
»Æѧ·“Ó¦ | Ę½ŗā³£Źż | ĪĀ¶Č | |
973K | 1173K | ||
¢ŁFe(s)£«CO2(g) | K1 | 1.47 | 2.15 |
¢ŚFe(s)£«H2O(g) | K2 | 2.38 | 1.67 |
¢ŪCO(g)£«H2O(g) | K3 | £æ | £æ |
(1)·“Ó¦¢ŁŹĒ________(Ģī”°ĪüČČ”±»ņ”°·ÅČČ”±)·“Ó¦”£
(2)Š“³ö·“Ó¦¢ŪµÄĘ½ŗā³£ŹżK3µÄ±ķ“ļŹ½_______________________”£
(3)øł¾Ż·“Ó¦¢ŁÓė¢ŚæÉĶʵ¼³öK1”¢K2ÓėK3Ö®¼äµÄ¹ŲĻµ£¬ŌņK3£½________(ÓĆK1”¢K2±ķŹ¾)”£
(4)ŅŖŹ¹·“Ó¦¢ŪŌŚŅ»¶ØĢõ¼žĻĀ½ØĮ¢µÄĘ½ŗāĻņÄę·“Ó¦·½ĻņŅĘ¶Æ£¬æɲÉČ”µÄ“ėŹ©ÓŠ____(ĢīŠ“×ÖÄøŠņŗÅ)”£
A£®ĖõŠ”·“ӦȯĘ÷µÄČŻ»żB£®Ą©“ó·“ӦȯĘ÷µÄČŻ»ż
C£®ÉżøßĪĀ¶ČD£®Ź¹ÓĆŗĻŹŹµÄ“߻ƼĮ
E£®Éč·Ø¼õŠ”Ę½ŗāĢåĻµÖŠµÄCOÅضČ
(5)Čō·“Ó¦¢ŪµÄÄę·“Ó¦ĖŁĀŹÓėŹ±¼äµÄ¹ŲĻµČēĶ¼ĖłŹ¾£ŗ

¢Łæɼū·“Ó¦ŌŚt1”¢t3”¢t7Ź±¶¼“ļµ½ĮĖĘ½ŗā£¬¶ųt2”¢t8Ź±¶¼øıäĮĖŅ»ÖÖĢõ¼ž£¬ŹŌÅŠ¶ĻøıäµÄŹĒŹ²Ć“Ģõ¼ž£ŗt2Ź±________£»t8Ź±________”£
¢ŚČōt4Ź±½µŃ¹£¬t6Ź±Ōö“ó·“Ó¦ĪļµÄÅØ¶Č£¬ĒėŌŚĶ¼ÖŠ»³öt4”«t6Ź±Äę·“Ó¦ĖŁĀŹÓėŹ±¼äµÄ¹ŲĻµĒśĻß”£__________
¢ņ£®25”ę£¬1.01”Į105PaŹ±£¬16gŅŗĢ¬¼×“¼(CH3OH)ĶźČ«Č¼ÉÕ£¬µ±»Öø“µ½ŌדĢ¬Ź±£¬·Å³ö363.3kJµÄČČĮ棬Š“³öøĆ·“Ó¦µÄČČ»Æѧ·½³ĢŹ½__________







