题目内容
【题目】一定质量的甲烷燃烧后得到的产物为CO、CO2和水蒸气,此混合气体质量为49.6g,当其缓慢经过无水CaCl2时,CaCl2增重25.2g,原混合气体中CO2的质量为( )
A.12.5gB.13.2gC.19.7gD.24.4g
【答案】B
【解析】
产物通过无水CaCl2时,无水CaCl2增重25.2g为水的质量,则![]() ,根据H原子守恒,可以知道
,根据H原子守恒,可以知道![]() ,又m(CO)+m(CO2)=49.6g-25.2g=24.4g,则[0.7mol-n(CO2)]×28g·mol-1+n(CO2)×44g·mol-1=24.4g,解之得,n(CO2)=0.3mol,则m(CO2)=0.3mol×44g·mol-1=13.2g,故答案选B。
,又m(CO)+m(CO2)=49.6g-25.2g=24.4g,则[0.7mol-n(CO2)]×28g·mol-1+n(CO2)×44g·mol-1=24.4g,解之得,n(CO2)=0.3mol,则m(CO2)=0.3mol×44g·mol-1=13.2g,故答案选B。

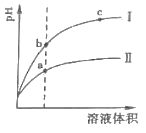
【题目】与化学平衡类似,电离平衡的平衡常数,叫做电离常数(用k表示).下表是25℃下几种常见弱酸的电离平衡常数:
酸 | 电离方程式 | 电离平衡常数K |
CH3COOH | CH3COOH | 1.96×10-5 |
HClO | HClO | 3.0×10-8 |
H2CO3 | H2CO3 HCO3- | K1=4.4×10-7 K2=5.6×10-11 |
H2SO3 | H2SO3 HSO3- | K1=1.54×10-2 K2= 1.02×10-7 |
回答下列问题:
(1)CH3COOH、HClO、H2CO3、HCO3-、H2SO3、HSO3-都可看作是酸,其中酸性最强的是_________,最弱的是________________。
(2)向Na2CO3溶液中通入足量的氯气,发生的离子方程式为______________________,向NaClO溶液中通入少量的二氧化硫,发生的离子方程式为____________________________________。
(3)求25℃时,1.2mol/L 的NaClO溶液pH=____________(己知:lg2=0.3),0.10mol/L的CH3COOH溶液中的c(H+)=______________mol/L。
【题目】下面a~e是中学化学实验中常见的几种定量仪器:
a.量筒 b.容量瓶 c.滴定管 d.托盘天平 e.温度计
(1)无“0”刻度的是___(填字母)。
(2)下列操作合理的是___(填字母)。
A.用25 mL碱式滴定管量取20.00 mL NaHCO3溶液
B.用托盘天平准确称量10.20 g碳酸钠固体
C.用100 mL量筒量取3.2 mL浓硫酸
D.用240 mL容量瓶配制240mL 1 mol·L-1的氢氧化钠溶液
(3)某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,若滴定开始和结束时,酸式滴定管中的液面如图所示:则所用盐酸的体积为___mL。

(4)某学生根据三次实验分别记录有关数据如下表:
滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积 | ||
第一次 | 25.00 | 0.00 | 26.05 | 26.05 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.36 | 26.31 | 25.95 |
请选用其中合理数据列出该氢氧化钠溶液物质的量浓度:c(NaOH)=___mol·L-1。
(5)由于错误操作,使得上述所测氢氧化钠溶液的浓度偏高的是___(填字母)。
A.滴定达终点时俯视滴定管内液面读数
B.碱式滴定管用蒸馏水洗净后立即取用25.00 mL待测碱溶液注入锥形瓶进行滴定
C.锥形瓶用待测碱液润洗
D.滴定时酸式滴定管中盐酸洒落在锥形瓶外