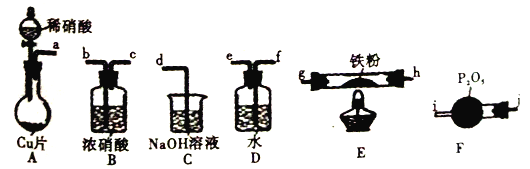
题目内容
【题目】设![]() 为阿伏伽德罗常数的数值,则下列说法中不正确的是
为阿伏伽德罗常数的数值,则下列说法中不正确的是
![]() 常温下,21g聚乙烯
常温下,21g聚乙烯![]() 中含有氢原子的数目为
中含有氢原子的数目为![]()
![]() 在
在![]() 反应中每生成71g氯气转移的电子数为
反应中每生成71g氯气转移的电子数为![]()
![]() 中含
中含![]() 键数目为
键数目为![]()
![]() 过氧化钠与水反应,若转移
过氧化钠与水反应,若转移![]() 个电子,则产生的氧气为32g
个电子,则产生的氧气为32g
![]() 在
在![]() 的碳酸钠溶液中,
的碳酸钠溶液中,![]() 总数为
总数为![]() .
.
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
【答案】D
【解析】
![]() 聚乙烯的最简式为
聚乙烯的最简式为![]() ,根据聚乙烯的最简式计算出21g聚乙烯中含有的H原子的物质的量;
,根据聚乙烯的最简式计算出21g聚乙烯中含有的H原子的物质的量;
![]() 反应
反应![]() 浓
浓![]() 中,
中,![]() 中Cl元素由
中Cl元素由![]() 价变为
价变为![]() 价,HCl中Cl元素由
价,HCl中Cl元素由![]() 价变为0价,由方程式可知当有6molHCl参加反应时,有5mol被氧化,转移5mol电子,生成
价变为0价,由方程式可知当有6molHCl参加反应时,有5mol被氧化,转移5mol电子,生成![]() ,以此进行计算;
,以此进行计算;
![]() 氨气分子中含有3个氮氢键,
氨气分子中含有3个氮氢键,![]() 氨气的物质的量为
氨气的物质的量为![]() ,含有
,含有![]() 氮氢键;
氮氢键;
![]() 过氧化钠与水反应中,过氧化钠既是氧化剂也是还原剂,且过氧化钠中氧元素的化合价为
过氧化钠与水反应中,过氧化钠既是氧化剂也是还原剂,且过氧化钠中氧元素的化合价为![]() 价,则生成1mol氧气转移了2mol电子,据此进行计算;
价,则生成1mol氧气转移了2mol电子,据此进行计算;
![]() 在
在![]() 的碳酸钠溶液中,
的碳酸钠溶液中,![]() 部分水解,导致溶液中碳酸根离子数目减少。
部分水解,导致溶液中碳酸根离子数目减少。
![]() 聚乙烯
聚乙烯![]() 的最简式为
的最简式为![]() ,21g聚乙烯中含有最简式
,21g聚乙烯中含有最简式![]() 的物质的量为:
的物质的量为:![]() ,含有H原子的物质的量为
,含有H原子的物质的量为![]() ,含有氢原子的数目为
,含有氢原子的数目为![]() ,故
,故![]() 正确;
正确;
![]() 反应中
反应中![]() 中,只有Cl元素化合价发生变化,
中,只有Cl元素化合价发生变化,![]() 为氧化剂,HCl为还原剂,电子转移的方向和数目为:
为氧化剂,HCl为还原剂,电子转移的方向和数目为: ,当有
,当有![]() 生成时,转移5mol电子,71g氯气的物质的量为:
生成时,转移5mol电子,71g氯气的物质的量为:![]() ,则生成1mol氯气时转移的电子为:
,则生成1mol氯气时转移的电子为:![]() ,故
,故![]() 错误;
错误;
![]() 氨气的物质的量为:
氨气的物质的量为:![]() ,
,![]() 氨气分子中含有氮氢键的物质的量为:
氨气分子中含有氮氢键的物质的量为:![]() ,含
,含![]() 键数目为
键数目为![]() ,故
,故![]() 错误;
错误;
![]() 氧气的物质的量为1mol,过氧化钠中氧元素的化合价为
氧气的物质的量为1mol,过氧化钠中氧元素的化合价为![]() 价,则生成1mol氧气转移了2mol电子,即转移
价,则生成1mol氧气转移了2mol电子,即转移![]() 个电子,故
个电子,故![]() 正确;
正确;
![]() 在1L0.1mol·L-1的碳酸钠溶液中,含有溶质碳酸钠的物质的量为
在1L0.1mol·L-1的碳酸钠溶液中,含有溶质碳酸钠的物质的量为![]() ,由于碳酸根离子部分水解,则溶液中的
,由于碳酸根离子部分水解,则溶液中的![]() 总数小于
总数小于![]() ,故
,故![]() 错误;
错误;
根据分析可知,不正确的为![]() ,
,
故选D。

【题目】下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 用双氧水滴定KI-淀粉溶液 | 溶液变蓝 | 达到滴定终点 |
B | 向食用加碘盐中加入食醋和KI溶液,再加入CCl4振荡,静置 | 下层呈紫红色 | 该食用加碘盐中含有KIO3 |
C | 用湿润的淀粉碘化钾试纸鉴别NO2、溴蒸气 | 试纸变蓝 | 该气体为溴蒸气 |
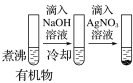
D |
| 最后试管有浅黄色沉淀 | 有机物中含有溴原子 |
A. AB. BC. CD. D