题目内容
17. 现有部分元素的存在、性质或原子结构如表所示:
现有部分元素的存在、性质或原子结构如表所示:| A | 最外层电子数是次外层电子数的2倍的元素 |
| B | 最高正价为+7价的短周期元素 |
| C | 最外层电子数等于电子层数的短周期元素 |
| D | 地壳中含量居第二位的金属元素 |
| E | 其氢化物在同主族元素氢化物中熔沸点最高 |
| F | 短周期元素中原子半径(除稀有气体外)最大的元素 |
(1)写出由上述条件可以确定的元素的元素符号:C、Cl、Fe、Na.
(2)若E的气态氢化物能与E的最高价氧化物对应的水化物发生化合反应生成离子化合物,则E的气态氢化物的电子式为:
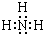 ,空间构型为:三角锥形.
,空间构型为:三角锥形.(3)已知由至少满足表中一项条件的元素所组成的高中常见的物质之间可以发生如下图所示的转化关系.其中甲、乙、丙为含有同一种元素的纯净物(反应条件略).
若X为非金属元素的单质,图中反应均为氧化还原反应,则X为C(填化学式),反应Ⅲ的化学方程式为2CO+O2 $\frac{\underline{\;点燃\;}}{\;}$2CO2.
分析 (1)A元素原子最外层电子数是次外层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故A为碳元素;B是最高正价为+7价的短周期元素,则B为Cl;C是最外层电子数等于电子层数的短周期元素,则C为H或Be或Al;D是地壳中含量居第二位的金属元素,则D为Fe;E的氢化物在同主族元素氢化物中熔沸点最高,分子之间存在氢键,可能为N或O或F;F是短周期元素中原子半径(除稀有气体外)最大的元素,则F为Na;
(2)若E的气态氢化物能与E的最高价氧化物对应的水化物发生化合反应生成离子化合物,则E为N元素,则E的气态氢化物为NH3;
(3)甲、乙、丙为含有同一种元素的纯净物,若X为非金属元素的单质,图中反应均为氧化还原反应,甲为氧气、X为碳、乙为CO2、丙为CO等符合转化过程.
解答 解:A元素原子最外层电子数是次外层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故A为碳元素;B是最高正价为+7价的短周期元素,则B为Cl;C是最外层电子数等于电子层数的短周期元素,则C为H或Be或Al;D是地壳中含量居第二位的金属元素,则D为Fe;E的氢化物在同主族元素氢化物中熔沸点最高,分子之间存在氢键,可能为N或O或F;F是短周期元素中原子半径(除稀有气体外)最大的元素,则F为Na.
(1)由上述分析可知,可以确定的元素为C、Cl、Fe、Na,故答案为:C、Cl、Fe、Na;
(2)若E的气态氢化物能与E的最高价氧化物对应的水化物发生化合反应生成离子化合物,则E为N元素,则E的气态氢化物为NH3,电子式为: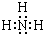 ,空间构型为:三角锥形,
,空间构型为:三角锥形,
故答案为: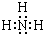 ;三角锥形;
;三角锥形;
(3)甲、乙、丙为含有同一种元素的纯净物,若X为非金属元素的单质,图中反应均为氧化还原反应,甲为氧气、X为碳、乙为CO2、丙为CO等符合转化过程,反应Ⅲ的化学方程式为:2CO+O2 $\frac{\underline{\;点燃\;}}{\;}$2CO2,
故答案为:C;2CO+O2 $\frac{\underline{\;点燃\;}}{\;}$2CO2.
点评 本题考查结构性质位置关系应用、无机物推断等,难度不大,(3)为开放性题目,答案不唯一,需要学生熟练掌握元素化合物中学.

| A. | 若该溶液为Ba(OH)2,则充分反应后金属有剩余 | |
| B. | 若该溶液为H2SO4,则充分反应后金属有剩余 | |
| C. | 若该溶液分别为H2SO4、NaOH,则两者产生的氢气的物质的量相等 | |
| D. | 若该溶液为碳酸,则产生氢气后金属有剩余 |
| A. | 非金属性:X最强,Z最弱 | |
| B. | 原子半径:X最大,Z最小 | |
| C. | 气态氢化物稳定性:HX最强 | |
| D. | 气态氢化物水溶液酸性:ZH3<H2Y<HX |
| A. | 0.5 mol•L-1 | B. | 0.8 mol•L-1 | C. | 1.0 mol•L-1 | D. | 1.5 mol•L-1 |
| A. | 10℃,5mL0.1mol•L-1Na2S2O3(aq)+5mL0.1mol•L-1 H2SO4(aq) | |
| B. | 10℃,10mL0.05mol•L-1 Na2S2O3 (aq)+10mL0.1mol•L-1H2SO4(aq) | |
| C. | 20℃,5mL0.1mol•L-1 Na2S2O3(aq)+5mL0.1mol•L-1 H2SO4(aq) | |
| D. | 20℃,10mL0.05mol•L-1 Na2S2O3(aq)+10mL0.05mol•L-1H2SO4(aq) |
| A. | 254gI2(g)中通入2gH2(g),反应放热9.48kJ | |
| B. | 反应(Ⅰ)的产物比反应(Ⅱ)的产物稳定 | |
| C. | 反应(Ⅱ)的反应物总能量比反应(Ⅰ)的反应物总能量低 | |
| D. | 1mol固态碘与1mol气态碘所含的能量相差17.00kJ |
| A. | 在氮化铝的合成反应中,N2是还原剂,Al2O3氧化剂 | |
| B. | 上述反应中每生成2molAlN,N失去6mol电子 | |
| C. | 氮化铝中氮元素的化合价为-3 | |
| D. | 氮化铝的摩尔质量为41g/mol |