题目内容
6.根据碘与氢气反应的化学方程式(其中“+”表示放出热量):(Ⅰ)I2(g)+H2(g)?2HI(g)+9.48kJ;(Ⅱ)I2(s)+H2(g)?2HI(g)-26.48kJ.下列判断正确的是( )| A. | 254gI2(g)中通入2gH2(g),反应放热9.48kJ | |
| B. | 反应(Ⅰ)的产物比反应(Ⅱ)的产物稳定 | |
| C. | 反应(Ⅱ)的反应物总能量比反应(Ⅰ)的反应物总能量低 | |
| D. | 1mol固态碘与1mol气态碘所含的能量相差17.00kJ |
分析 A、该反应是可逆反应,所以不能进行完全;
B、根据盖斯定律,(Ⅰ)-(Ⅱ)得I2(g)=I2(S)+35.96kJ;
C、反应(Ⅰ)、反应(Ⅱ)的产物都是HI(g);
D、对于同一物质,固态物质的能量比气态物质能量低.
解答 解:A.因为是可逆反应,所以不能进行完全,放热小于9.48kJ,故A错误;
B.反应(Ⅰ)、反应(Ⅱ)的产物都是HI(g),状态相同,稳定性一样,故B错误;
C.对于同一物质,固态物质的能量比气态物质能量低,故反应(Ⅱ)的反应物总能量比反应(Ⅰ)的反应物总能量低,故C正确;
D.由盖斯定律知(Ⅰ)-(Ⅱ)得I2(g)=I2(S)+35.96kJ,故1 mol固态碘与1 mol气态碘所含的能量相差35.96kJ,故D错误,
故选:C.
点评 本题考查对于热化学方程式的理解、可逆反应特点、物质状态与能量关系等,注意题目中“+”表示放热,“-”表示吸热,题目难度中等.

练习册系列答案
相关题目
16.有机物(CH3)2CHCH2CH3的二氯代物有 ( )
| A. | 9种 | B. | 10种 | C. | 11种 | D. | 12种 |
17. 现有部分元素的存在、性质或原子结构如表所示:
现有部分元素的存在、性质或原子结构如表所示:
请回答下列问题:
(1)写出由上述条件可以确定的元素的元素符号:C、Cl、Fe、Na.
(2)若E的气态氢化物能与E的最高价氧化物对应的水化物发生化合反应生成离子化合物,则E的气态氢化物的电子式为: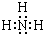 ,空间构型为:三角锥形.
,空间构型为:三角锥形.
(3)已知由至少满足表中一项条件的元素所组成的高中常见的物质之间可以发生如下图所示的转化关系.其中甲、乙、丙为含有同一种元素的纯净物(反应条件略).
若X为非金属元素的单质,图中反应均为氧化还原反应,则X为C(填化学式),反应Ⅲ的化学方程式为2CO+O2 $\frac{\underline{\;点燃\;}}{\;}$2CO2.
 现有部分元素的存在、性质或原子结构如表所示:
现有部分元素的存在、性质或原子结构如表所示:| A | 最外层电子数是次外层电子数的2倍的元素 |
| B | 最高正价为+7价的短周期元素 |
| C | 最外层电子数等于电子层数的短周期元素 |
| D | 地壳中含量居第二位的金属元素 |
| E | 其氢化物在同主族元素氢化物中熔沸点最高 |
| F | 短周期元素中原子半径(除稀有气体外)最大的元素 |
(1)写出由上述条件可以确定的元素的元素符号:C、Cl、Fe、Na.
(2)若E的气态氢化物能与E的最高价氧化物对应的水化物发生化合反应生成离子化合物,则E的气态氢化物的电子式为:
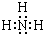 ,空间构型为:三角锥形.
,空间构型为:三角锥形.(3)已知由至少满足表中一项条件的元素所组成的高中常见的物质之间可以发生如下图所示的转化关系.其中甲、乙、丙为含有同一种元素的纯净物(反应条件略).
若X为非金属元素的单质,图中反应均为氧化还原反应,则X为C(填化学式),反应Ⅲ的化学方程式为2CO+O2 $\frac{\underline{\;点燃\;}}{\;}$2CO2.
14.下列说法正确的是( )
①在水中氢、氧原子间均以化学键相结合
②金属和非金属化合形成离子键
③离子键是阳离子,阴离子的相互吸引
④两个非金属原子间不可能形成离子键
⑤非金属原子间不可能形成离子键
⑥离子化合物可能共价键
⑦共价化合物中可能有离子键.
①在水中氢、氧原子间均以化学键相结合
②金属和非金属化合形成离子键
③离子键是阳离子,阴离子的相互吸引
④两个非金属原子间不可能形成离子键
⑤非金属原子间不可能形成离子键
⑥离子化合物可能共价键
⑦共价化合物中可能有离子键.
| A. | ①②③ | B. | ②④⑤ | C. | ④⑥ | D. | ①②③④⑤⑥ |
1.关于吸热反应的说法正确的是( )
| A. | 凡需加热的反应一定是吸热反应 | |
| B. | 只有分解反应才是吸热反应 | |
| C. | 吸热反应一定不能在常温下进行 | |
| D. | 已知CO2与CaO化合是放热反应,则CaCO3分解是吸热反应 |
11.关于下列室温下的溶液的一些说法中,完全正确的是( )
①pH=4FeCl3溶液;②pH=10Na2CO3溶液;③pH=2HCl溶液;④pH=3CH3COOH溶液;⑤pH=11NaOH溶液;⑥pH=3NH4Cl溶液.
①pH=4FeCl3溶液;②pH=10Na2CO3溶液;③pH=2HCl溶液;④pH=3CH3COOH溶液;⑤pH=11NaOH溶液;⑥pH=3NH4Cl溶液.
| A. | 水的电离程度:①=②、③<④、⑤=⑥ | |
| B. | ④、⑤溶液等体积混合后所得溶液中水的电离程度大于纯水的电离程度 | |
| C. | ⑤、⑥溶液等体积混合后所得溶液中离子浓度顺序是c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| D. | ②溶液中:c(H+)+c(H2CO3)+c(HCO3-)=c(OH-) |
18.原子序数依次增大的四种短周期元素X、Y、Z、W,X与Z同主族且X最外层电子比次外层电子多2个,Y元素的周期序数等于族序数,W元素的最高正价与最低负价代数和为4,下列说法错误的是( )
| A. | 最高价氧化物对应水化物的酸性:W>X>Z>Y | |
| B. | 氢化物的稳定性:X>Z | |
| C. | Y单质可用于钢轨的焊接 | |
| D. | 原子半径大小顺序:X<Y<Z<W |
15.在原子序随着卤素原子核电荷数的增加,下列递变规律正确的是( )
| A. | 单质的熔沸点逐渐降低 | B. | 气态氢化物的稳定性逐渐降低 | ||
| C. | 卤素最高价含氧酸酸性逐渐增强 | D. | 卤素单质的氧化性逐渐增强 |
16.下列仪器装置的使用正确且能达到相应实验目的有 ( )
| A. |  用托盘天平快速称量一定质量的氢氧化钠固体 | |
| B. |  使用橡皮管能使漏斗中的水顺利流下 | |
| C. |  分离Cl2与KI溶液反应生成的碘 | |
| D. |  分离Cl2与KI溶液反应生成的碘 | |
| E. | 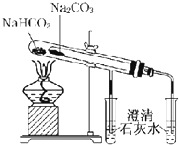 比较Na2CO3和NaHCO3的热稳定性 | |
| F. | 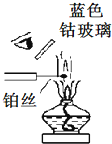 用焰色反应检验钾离子 |