题目内容
5.下列各题中有关物质的比较,请用“>”、“<”、“=”填空:(1)酸性:H3PO4<HNO3,H2SO4<HClO4.
(2)氧化性:F2>S,O2>N2.
(3)气态氢化物稳定性:CH4<NH3,HCl>HI.
(4)碱性:Mg(OH)2< Ca(OH)2,Al(OH)3< Mg(OH)2.
(5)还原性:H2O<H2S,HCl<H2S.
分析 (1)元素的非金属性越强,其最高正价含氧酸的酸性越强;
(2)元素的非金属性越强,其得电子能力越强,则元素的氧化性越强,对应单质的氧化性越强;
(3)同周期元素从左到右非金属性逐渐增强,同主族元素从上到下元素的非金属性逐渐减弱;
(4)同主族自上而下,金属性增强,同周期元素从左到右金属性逐渐减弱,金属性越强,最高价氧化物对应水化物的碱性越强;
(5)非金属性越强,对应氢化物的还原性的还原性越弱.
解答 解:(1)同一周期元素,其非金属性随着原子序数的增大而增强,所以非金属性S<Cl,同一主族元素,其非金属性随着原子序数的增大而减小,所以非金属性P<N,所以酸性:H3PO4<HNO3,H2SO4<HClO4,
故答案为:<;<;
(2)同周期元素从左向右非金属性增强,非金属性Cl>S,同主族元素从上到下非金属性减弱非金属性F>Cl,非金属性F>Cl>S,则非金属性F>S,则单质的氧化性F2>S,同周期元素从左向右非金属性增强,非金属性O>N,则单质的氧化性O2>N2,
故答案为:>;>;
(3)同周期元素从左到右非金属性逐渐增强,非金属性:N>C,则有稳定性:CH4>NH3,同主族元素从上到下元素的非金属性逐渐减弱,非金属性:Cl>I,且非金属性越强,对应的氢化物越稳定,则有稳定性:HCl>HI,
故答案为:<;>;
(4)同主族自上而下,金属性增强,所以金属性Ca>Mg,金属性越强,最高价氧化物对应水化物的碱性越强,所以碱性:Ca(OH)2>Mg(OH)2,同周期元素从左到右金属性逐渐减弱,所以金属性Mg>Al,金属性越强,最高价氧化物对应水化物的碱性越强,所以碱性:Mg(OH)2>Al(OH)3,
故答案为:<;<;
(5)非金属性O>S,氢化物的还原性:H2O<H2S,非金属性Cl>S,对应氢化物的还原性为HCl<H2S,
故答案为:<;<.
点评 本题考查了元素周期律,明确元素非金属性与其最高价含氧酸酸性、氢化物的稳定性的关系即可解答,熟练掌握元素周期律内涵,并会灵活运用,题目难度中等.

①a-4 ②a-5 ③a+3 ④a+4.
| A. | ①④ | B. | ②③ | C. | ①③ | D. | ②④ |
| A. | 9种 | B. | 10种 | C. | 11种 | D. | 12种 |
| A. | 该物质属于混合物 | B. | 硫元素的化合价为+2 | ||
| C. | 化学名称是二氧化硫 | D. | 硫元素和氧元素的质量比为1:2 |
| A. | Al2O3→Al(OH)3 | B. | Al→Na[Al (OH)4] | C. | Fe→FeCl2 | D. | Na→Na2O2 |
 现有部分元素的存在、性质或原子结构如表所示:
现有部分元素的存在、性质或原子结构如表所示:| A | 最外层电子数是次外层电子数的2倍的元素 |
| B | 最高正价为+7价的短周期元素 |
| C | 最外层电子数等于电子层数的短周期元素 |
| D | 地壳中含量居第二位的金属元素 |
| E | 其氢化物在同主族元素氢化物中熔沸点最高 |
| F | 短周期元素中原子半径(除稀有气体外)最大的元素 |
(1)写出由上述条件可以确定的元素的元素符号:C、Cl、Fe、Na.
(2)若E的气态氢化物能与E的最高价氧化物对应的水化物发生化合反应生成离子化合物,则E的气态氢化物的电子式为:
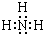 ,空间构型为:三角锥形.
,空间构型为:三角锥形.(3)已知由至少满足表中一项条件的元素所组成的高中常见的物质之间可以发生如下图所示的转化关系.其中甲、乙、丙为含有同一种元素的纯净物(反应条件略).
若X为非金属元素的单质,图中反应均为氧化还原反应,则X为C(填化学式),反应Ⅲ的化学方程式为2CO+O2 $\frac{\underline{\;点燃\;}}{\;}$2CO2.
①在水中氢、氧原子间均以化学键相结合
②金属和非金属化合形成离子键
③离子键是阳离子,阴离子的相互吸引
④两个非金属原子间不可能形成离子键
⑤非金属原子间不可能形成离子键
⑥离子化合物可能共价键
⑦共价化合物中可能有离子键.
| A. | ①②③ | B. | ②④⑤ | C. | ④⑥ | D. | ①②③④⑤⑥ |
| A. | 单质的熔沸点逐渐降低 | B. | 气态氢化物的稳定性逐渐降低 | ||
| C. | 卤素最高价含氧酸酸性逐渐增强 | D. | 卤素单质的氧化性逐渐增强 |
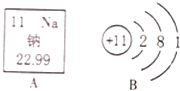 如图中A是钠元素在元素周期表中的相关信息,B是钠原子结构示意图.
如图中A是钠元素在元素周期表中的相关信息,B是钠原子结构示意图.