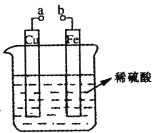
题目内容
【题目】含第VA族的磷、砷(As)等元素的化合物在研究和生产中有许多重要用途。回答下列问题:
(1)基态P原子的核外电子排布式为____,有____个未成对电子。
(2)常温下PCl5是一种白色晶体,其立方晶系晶体结构模型如图甲所示,由A、B两种微粒构成。将其加热至148℃熔化,形成一种能导电的熔体。已知A、B两种微粒分别与CC14、SF6互为等电子体,则A为____,其中心原子杂化轨道类型为____,B为____。
(3)PO43-的空间构型为____,其等电子体有____(请写出一种)。
(4)砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其10%。推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措。已知砷化镓的晶胞结构如图乙,晶胞参数a= 565pm。

①砷化镓的化学式为____,镓原子的配位数为____。
②砷化镓的晶胞密度=____g/cm3(列式并计算,精确到小数点后两位),m位置Ga原子与n位置As原子之间的距离为____pm(列式表示)。
【答案】1s22s22p63s23p3 3 ![]() sp3
sp3 ![]() 正四面体 SO42- GaAs 4
正四面体 SO42- GaAs 4 ![]()
![]()
【解析】
(1)根据构造原理,按照电子排布顺序(1s2s2p3s3p4s3d4p5s4d5p6s4f……)进行电子排布,再画出电子排布图分析未成对电子;
(2)PCl5晶体中含有两种微粒,熔融能导电,说明这两种微粒是阴阳离子,再根据A、B两种微粒分别与CC14、SF6互为等电子体,分析作答;
(3)PO43-的孤电子对数为(5-8+3)/2=0,σ键电子对数为4,据此分析构型;原子数为5,价电子数为32,据此找等电子体;
(4)①利用均摊法计算:黑球4个全部在晶胞内,白球位于晶胞顶点和面心,配位数通过观察晶胞分析;
②砷化镓的晶胞含4个CaAs,先计算4个CaAs的质量(70+75) ×4g/NA,再晶胞的体积为a3=(565×10-10)3 cm3,最后通过![]() 求算。m与n之间的距离为晶胞体对角线的
求算。m与n之间的距离为晶胞体对角线的![]() 。
。
(1)根据构造原理,基态P原子的核外电子排布式为1s22s22p63s23p3,电子排布图为:![]() ,有3个未成对电子。答案:1s22s22p63s23p3 ;3;
,有3个未成对电子。答案:1s22s22p63s23p3 ;3;
(2)常温下PCl5是一种白色晶体,由A、B两种微粒构成。将其加热至148℃熔化,形成一种能导电的熔体,这说明形成的是离子晶体。已知A、B两种微粒分别与CCl4、SF6互为等电子体,由于原子总数和价电子总数分别都相等的是等电子体,则A为PCl4+,P原子的价层电子对数是4,且不存在孤电子对,因此其中心原子杂化轨道类型为sp3,B为PCl6-。答案:PCl![]() ;sp3 ;PCl
;sp3 ;PCl![]() 。
。
(3) PO43-的中心原子P的价层电子对数是4,由于孤电子对数为0,该离子的空间构型为正四面体形,其等电子体有SO42-、CCl4等。答案:正四面体;SO42-;
(4)①晶胞中黑球位于晶胞内,数目为4,白球位于晶胞顶点和面心,数目为8×1/8+6×1/2=4,数目为1:1,则砷化镓的化学式为CaAs;根据晶胞As原子的配位数为4,则镓原子距离最近的As原子数目也为4,即配位数为4;
②砷化镓的晶胞含4个CaAs,则1mol晶胞的质量为(70+75)× 4g,晶胞的体积为a3=(565×10-10)3 cm3,1mol晶胞的体积为6.02×1023×(565×10-10)3 cm3,则晶胞的密度为(70+75) ×4g/[6.02×1023×(565×10-10)3 cm3]=5.34 g/cm3;m位置As原子与n位置Ga原子之间的距离为晶胞体对角线的1/4,则距离为![]() ×565 pm=
×565 pm=![]() pm。答案:
pm。答案:![]() 。
。

 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
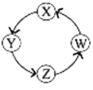
计算高手系列答案【题目】X、Y、Z、W 四种物质间的转化关系如图所示 ,下列转化不能一步实现的是( )
序号 | X | Y | Z | W | 转化关系 |
A | FeCl3 | FeCl2 | Fe(OH)2 | Fe(OH)3 |
|
B | Na | NaOH | Na2CO3 | NaCl | |
C | Cl2 | Ca(ClO)2 | HClO | HCl | |
D | H2S | S | SO3 | H2SO4 |
A.AB.BC.CD.D
【题目】下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
选项 | 实验 | 现象 | 结论 |
A | 向蔗糖中加入浓硫酸 | 蔗糖变黑 | 浓硫酸具有吸水性 |
B | 向酸性KMnO4 溶液中滴加乙醇 | 溶液褪色 | 乙醇具有还原性 |
C | 向溴水中加入苯,充分振荡、静 置 | 水层几乎无色 | 苯与溴发生了反应 |
D | 向FeCl3和BaCl2 的混合溶液中通入足量SO2 | 溶液变为浅绿色且有白色沉淀生成 | Fe3+被还原为Fe2+,白色沉淀为BaSO3 |
A.AB.BC.CD.D