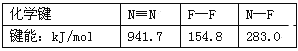题目内容
【题目】我国成功研制了铯(133Cs)原子喷泉钟。已知该铯原子的核外电子数为55,则该原子的中子数为( )
A. 23 B. 55 C. 78 D. 133
【答案】C
【解析】试题分析:核外电子数=质子数,中子数=质量数-质子数=133-55=78,故选项C正确。

 阅读快车系列答案
阅读快车系列答案【题目】如图依次为气体制得、除杂并检验其性质的装置(加热及夹持仪器省略)。下列设计不能达到目的的是( )
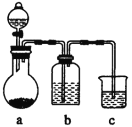
选项 | 气体 | 装置中药品 | ||
a | b | c | ||
A | C2H2 | 饱和食盐水+电石 | CuS04溶液 | 溴水 |
B | CO2 | 稀盐酸+石灰石 | 饱和NaHC03溶液 | 苯酚蚋溶液 |
C | C2H4 | 溴乙烷+ NaOH乙醇溶液 | 水 | K2z Cr207,酸性溶液 |
D | SO2 | 碳+浓硫酸 | 新制氯水 | 品红溶液 |
【题目】(1)甲醇是重要的化工原料,又可做燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,主要反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2= -58 kJ/mol
CH3OH(g)+H2O(g) △H2= -58 kJ/mol
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
已知反应①中的相关的化学键键能数据如下:
化学键 | H-H | C-O | C (CO中的化学键) | H-O | C-H |
E/(kJ/mol) | 436 | 343 | 1076 | 465 | 413 |
回答下列问题:
①△H3=_____kJ/mol
②25℃,101 kPa条件下,测得16g甲醇完全燃烧释放出Q kJ的热量,请写出表示甲醇燃烧热的热化学方程式_______________
(2)25℃,将a mol·L-1氨水与b mol·L-1盐酸等体积混合后溶液呈中性,则此时溶液中c(NH4+)__________c(Cl-)(填“>”、“<”或“﹦”);用含a、b的代数式表示该温度下NH3·H2O的电离平衡常数Kb = _________
(3)800℃时,在2L密闭容器中发生反应2NO(g)+O2(g)![]() 2NO2(g),在反应体系中,n(NO)随时间的变化如下表所示:
2NO2(g),在反应体系中,n(NO)随时间的变化如下表所示:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
①下图中表示NO2变化的曲线是___________用O2表示从0~2s内该反应的平均速率v=____
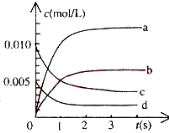
②能说明该反应已经达到平衡状态的是_______
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内的密度保持不变