题目内容
【题目】黄铜矿(CuFeS2)是制铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。
(1)冶炼铜的反应为8CuFeS2+21O2![]() 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是_____(填元素符号)。
(2)上述冶炼过程中产生大量SO2。下列处理方案合理的是_____(填代号)
a.高空排放b.用于制备硫酸c.用纯碱溶液吸收制Na2SO3 d.用浓硫酸吸收
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:![]() +2I-=2
+2I-=2![]() +I2
+I2
通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应的催化过程___、___
【答案】Cu、O b、c 2Fe3++2I-=2Fe2++I2 ![]() +2Fe2+=2
+2Fe2+=2![]() +2Fe3+
+2Fe3+
【解析】
(1)根据氧化还原反应中各元素化合价变化进行分析;
(2)根据SO2性质:有毒,属于酸性氧化物等性质进行分析;
(3)根据氧化还原反应原理和催化剂的催化原理进行分析解答。
(1)由8CuFeS2+21O2![]() 8Cu+4FeO+2Fe2O3+16SO2反应可知,化合价降低的元素是Cu、O ,发生还原反应,在反应中被还原,故答案为: Cu 、O;
8Cu+4FeO+2Fe2O3+16SO2反应可知,化合价降低的元素是Cu、O ,发生还原反应,在反应中被还原,故答案为: Cu 、O;
(2) a.因为SO2有毒,所以二氧化硫是污染性气体,排放到高空会污染空气,处理不合理,故a错误;
b.可以通过二氧化硫和水反应生成亚硫酸,亚硫酸不稳定易被空气氧化生成硫酸,所以可用二氧化硫制取硫酸,故b合理;
c.根据SO2性质可知,纯碱可以和二氧化硫反应生成Na2SO3,Na2SO3不稳定易被氧化生成Na2SO4,所以纯碱溶液可以吸收SO2,故c合理;
d.因为浓硫酸不能和二氧化硫反应,所以不能用浓硫酸吸收二氧化硫,故d错误;
故答案:b、c;
(3)三价铁具有强氧化性,能将碘离子氧化为碘单质;S2O82-具有氧化性能将亚铁离子氧化为Fe3+,其反应方程式分别为:2Fe3++2I-= 2Fe2++ I2,S2O82-+ 2Fe2+= 2SO42-+ 2Fe3+;
故答案为:2Fe3++2I-= 2Fe2++ I2,S2O82-+ 2Fe2+= 2SO42-+ 2Fe3+。

【题目】50mL 0.50mol·L-1盐酸与50mL 0.55mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
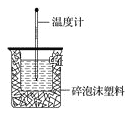
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是_______________,烧杯间填满碎泡沫塑料的作用是_________________。
(2)向盐酸中倒入NaOH溶液的正确操作是:________。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)大烧杯上如果不盖硬纸板,则求得的中和热 ________(填“偏大”、“偏小”或“无影响”)。
(4)两次实验记录的数据如下表:
实验用品 | 溶液温度 | 中和热 | |||
t1 | t2 | ΔH | |||
① | 50mL 0.55mol/L NaOH溶液 | 50mL 0.5mol/L HCl溶液 | 20℃ | 23.3℃ | |
② | 50mL 0.55mol/L NaOH溶液 | 50mL 0.5mol/L HCl溶液 | 20℃ | 23.4℃ | |
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18kJ/(℃·kg),各溶液的密度均为1g/cm3。则中和热ΔH=_________kJ·mol-1。
(5)若改用60mL 0.50mol·L-1 盐酸和50mL 0.55mol·L-1 NaOH溶液进行反应与上述实验相比,所放出的热量_______(填“相等”“不相等”),若实验操作均正确,则所求中和热__________(填“相等”“不相等”)。