题目内容
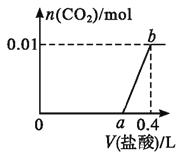
【题目】将一定质量的Mg和Al混合物投入400mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。
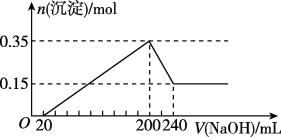
(1)原混合物中Mg和Al的质量之比为____。
(2)生成的H2在标准状况下的体积为____。
(3)加入NaOH溶液的物质的量浓度为____。
(4)稀硫酸的物质的量浓度为____。
(5)写出NaOH体积在200-240mL之间所发生的离子反应方程式____。
【答案】2∶3 10.08L 5mol/L 1.25mol/L Al(OH)3+OH-=AlO2-+2H2O
【解析】
由图象可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中硫酸溶解Mg、Al后硫酸有剩余,此时发生的反应为:
H2SO4+2NaOH=Na2SO4+2H2O;当V(NaOH溶液)=200mL时,沉淀量最大,此时沉淀为Mg(OH)2和Al(OH)3,二者物质的量之和为
0.35mol,溶液中溶质为Na2SO4;从200mL到240mL,NaOH溶解Al(OH)3,NaOH+Al(OH)3=NaAlO2+2H2O,当V(NaOH溶液)=
240mL时,沉淀不再减少,此时全部为Mg(OH)2,物质的量为0.15mol,所以沉淀量最大,Mg(OH)2为0.15mol,Al(OH)3为
0.35mol0.15mol=0.2mol。
(1)由元素守恒可知,n(Al)=n[Al(OH)3]=0.2mol,n(Mg)=n[Mg(OH)2]=0.15mol,所以镁和铝的质量之比为:0.15mol×24g/mol:
0.2mol×27g/mol=2:3,故答案为:2:3;
(2)由A中可知,n(Al)=0.2mol,n(Mg)=0.15mol,根据电子转移守恒可知2n(H2)=3n(Al)+2n(Mg)=3×0.2mol+2×0.15mol=
0.9mol,所以n(H2)=0.45mol,故氢气体积为0.45mol×22.4mol/L=10.08L,故答案为:10.08L;
(3)由200240mL发生Al(OH)3+NaOH=NaAlO2+2H2O,所以该阶段消耗n(NaOH)=n[Al(OH)3]=0.2mol,氢氧化钠的浓度为:0.2mol/(0.24L0.2L)=5mol/L,故答案为:5mol/L;
(4)沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液中溶质为Na2SO4,根据钠元素守恒可知此时n(Na2SO4)等于240mL氢氧化钠溶液中含有的n(NaOH)的1/2倍,所以n(Na2SO4)=1/2×0.2L×5mol/L=0.5mol,所以硫酸的浓度为:0.5mol/0.4L=1.25mol/L,故答案为:1.25mol/L;
(5)从200mL到240mL,NaOH溶解Al(OH)3,NaOH+Al(OH)3=NaAlO2+2H2O,其离子反应方程式为:Al(OH)3+OH-=AlO2-+
2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O。