题目内容
【题目】铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。在一定温度下,氧化铁可以与一氧化碳发生下列反应:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)。
2Fe(s)+3CO2(g)。
(1)①该反应的平衡常数表达式为:K=___。
②该温度下,在2L盛有Fe2O3粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g。则10min内CO的平均反应速率为___。
(2)请用上述反应中某种气体的有关物理量来说明该反应已达到平衡状态:①___②___。
(3)明矾KAl(SO4)2·12H2O的水溶液呈___性(填”酸性、碱性、中性),溶液中各离子的浓度从大到小的顺序为____。
(4)写出氢氧化铝在水中发生酸式电离的电离方程式:___,欲使上述体系中Al3+浓度增加,可加入的物质是____。
(5)某些金属氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应。下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是____。
a. b.
b. c.
c. d.
d.
【答案】![]() 0.015mol(Lmin) CO或(CO2)的生成速率与消耗速率相等 CO(或CO2)的质量不再改变 酸性 c(SO42-)>c(K+)>c(Al3+)>c(H+)>c(OH-) Al(OH)3
0.015mol(Lmin) CO或(CO2)的生成速率与消耗速率相等 CO(或CO2)的质量不再改变 酸性 c(SO42-)>c(K+)>c(Al3+)>c(H+)>c(OH-) Al(OH)3![]() H++AlO2-+H2O 盐酸 b
H++AlO2-+H2O 盐酸 b
【解析】
(1)①平衡常数为生成物的浓度幂之积除以反应物的浓度幂之积;
②先根据化学方程式计算出消耗的CO的物质的量,然后根据V=![]() =
=![]() 求出CO的化学反应速率;
求出CO的化学反应速率;
(2)根据化学平衡状态的特征分析,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、质量、体积分数以及百分含量不变;
(3)明矾是KAl(SO4)212H2O,结合铝离子水解呈酸性分析;
(4)根据Al(OH)3的酸式电离;根据Al(OH)3的碱式电离平衡以及外界条件对电离平衡的影响;
(5)根据通过加热引发铝热反应以及铝热反应为放热反应以及温度升高化学反应速率加快分析。
(1)①因平衡常数等于生成物浓度幂之积除以反应物浓度幂之积,则K=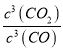 ;
;
②生成了单质铁的物质的量为:![]() =0.2mol,则:
=0.2mol,则:
Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g)
0.3mol 0.2mol
所以CO的反应速率V=![]() =
=![]() =
= =0.015mol/(Lmin);
=0.015mol/(Lmin);
(2)因当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、质量、体积分数以及百分含量不变,所以说CO或(CO2)的生成速率与消耗速率相等、CO(或CO2)的质量不再改变能说明该反应已达到平衡状态;
(3)明矾是KAl(SO4)212H2O,其溶液中铝离子水解生成氢氧化铝使溶液显酸性,水解离子反应为Al3++3H2O![]() Al(OH)3+3H+;溶液中不水解的二元硫酸根离子浓度最大,所以离子浓度大小顺序为:c(SO42-)>c(K+)>c(Al3+)>c(H+)>c(OH-);
Al(OH)3+3H+;溶液中不水解的二元硫酸根离子浓度最大,所以离子浓度大小顺序为:c(SO42-)>c(K+)>c(Al3+)>c(H+)>c(OH-);
(4)Al(OH)3的酸式电离:Al(OH)3![]() H++AlO2-+H2O,同时还存在碱式电离:Al(OH)3
H++AlO2-+H2O,同时还存在碱式电离:Al(OH)3![]() Al3++3OH-,加入盐酸,与OH-反应,碱式电离平衡正向移动,Al3+浓度增加;
Al3++3OH-,加入盐酸,与OH-反应,碱式电离平衡正向移动,Al3+浓度增加;
(5)因通过加热引发铝热反应,所以开始速率为零,一旦反应,反应放热,温度不断升高,化学反应速率加快,故答案为b。

 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案【题目】氮元素的单质和常见的化合物在工、农业生产中用途广泛。
(1)工业上利用分离空气的方法得到氮气.空气各主要成分的沸点如下:
N2 | O2 | Ar | CO2 |
-196℃ | -183℃ | -186℃ | -78℃ |
现将空气深度冷却液化,然后缓慢升温,则最先分离出来的气体是______.
(2)雷雨时空气中的N2转化为NO,生成物NO是______色的气体,______(填“易”或“难”)溶于水;NO在空气中很容易被氧化成NO2,NO2能与水发生化学反应,写出NO2与水反应的化学方程式为__________________.
(3)实验室可用固体NH4Cl与固体Ca(OH)2加热反应制取氨气;
①制取氨气的化学方程式为__________________;
②要制取标准状况下4.48L的氨气,至少需要称取固体NH4Cl的质量为______g;
(4)已知:4NH3+6NO![]() 5N2+6H2O化学研究性学习小组的同学在技术人员的指导下,按下列流程,探究不同催化剂对NH3还原NO反应的催化性能;
5N2+6H2O化学研究性学习小组的同学在技术人员的指导下,按下列流程,探究不同催化剂对NH3还原NO反应的催化性能; ![]()
若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体,通过一定体积滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同);
①NH3与稀硫酸溶液反应的离子方程式为__________________;
②为了比较不同催化剂的催化性能,需要测量并记录的数据是____________。