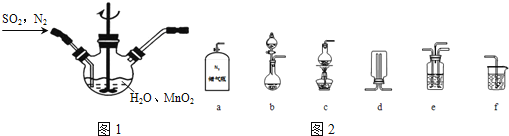
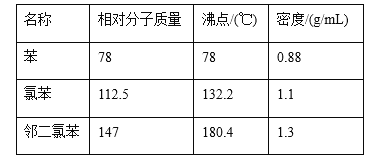
题目内容
【题目】I.在一定条件下,可逆反应A+B![]() mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,问:
mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,问:

(1)温度T1________T2(填“大于”“等于”或“小于”)。
(2)正反应是________反应(填“吸热”或“放热”)。
(3)如果A、B、C均为气体,则m________2(填“大于”“等于”或“小于”)。
(4)当温度和容积不变时,如在平衡体系中加入一定量的某稀有气体,则体系的压强________(填“增大”“减小”或“不变”),平衡________移动(填“向正反应方向”“向逆反应方向”或“不”)。
II.合成氨工业中氢气可由天然气和水蒸汽反应制备,其主要反应为:CH4+2H2O=CO2+4H2。
已知:CH4(g)+2O2(g)═CO2(g)+2H2O(l) △H =﹣890 kJ/mol
2H2(g)+O2(g)═2H2O(l) △H =﹣571.6 kJ/mol
H2O(g)=H2O(l) △H =﹣44 kJ/mol
写出由天然气和水蒸汽反应制备H2的热化学方程式:_________。
【答案】大于 放热 大于 增大 不 CH4(g)+2H2O(g)=CO2(g)+4H2(g) △H=+165.2 kJ/mol
【解析】
I.(1)根据温度升高,反应速率加快,到达平衡的时间越短判断温度T1、T2的高低;
(2)由图可知温度T1>T2,根据温度与C%关系判断平衡移动方向;
(3)由图可知,在T2温度时达到平衡后向容器加压,利用压强与C%的关系判断压强对平衡移动影响关系,进而判断方程式中化学计量数的大小;
(4)当温度和容积不变时,在平衡体系中加入一定量的某稀有气体,体系压强增大,但由于反应混合物的浓度不变,平衡不移动;
II.根据盖斯定律,将已知热化学方程式叠加,可得待求反应的热化学方程式。
I.(1)由图可知,温度为T1先到达平衡,由于温度越高反应速率越快,到达平衡的时间越短,故温度:T1>T2;
(2)由图可知温度:T1>T2,温度越高,达到平衡时生成物C的含量C%越小,说明升高温度,化学平衡向逆反应移动,根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动,逆反应为吸热反应,故该反应的正反应为放热反应;
(3)由图可知,T2温度时达到平衡后向容器加压,C%减小,说明增大压强,化学平衡向逆反应移动,由于增大压强,化学平衡向气体体积减小的方向移动,逆反应为气体体积减小的反应,故m>2;
(4)当温度和容积不变时,在平衡体系中加入一定量的某稀有气体,体系中气体物质的量增多,气体压强增大,但由于反应混合物的浓度不变,因此平衡不移动;
II.①CH4(g)+2O2(g)═CO2(g)+2H2O(l) △H =﹣890 kJ/mol
②2H2(g)+O2(g)═2H2O(l) △H =﹣571.6 kJ/mol
③H2O(g)=H2O(l) △H =﹣44 kJ/mol
根据盖斯定律①-②×2+③×2,得CH4(g)+2H2O(g)=CO2(g)+4H2(g) △H=+165.2 kJ/mol。

【题目】I.某温度时,在一个2L的密闭容器中,X、Y、Z三种气态物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:

①该反应的化学方程式为____________________________。
②从开始至2min,Z的平均反应速率为________________。
③若要提高X的转化率,请提出两条合理措施_______________________________、____________________________。
II.某探究性学习小组用相同质量的锌和相同浓度的足量的稀盐酸反应得到实验数据如表所示:
实验编号 | 锌的状态 | 反应温度/℃ | 收集100mL氢气 所需时间/s |
Ⅰ | 薄片 | 15 | 200 |
Ⅱ | 薄片 | 25 | 90 |
Ⅲ | 粉末 | 25 | 10 |
①该实验的目的是探究__________、__________对锌和稀盐酸反应速率的影响;
②实验Ⅰ和Ⅱ表明__________,化学反应速率越大;
③能表明固体的表面积对反应速率有影响的实验编号是 ______ 和 ______ 。