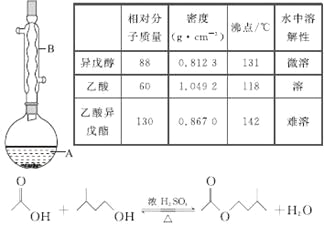
题目内容
【题目】(1)下列物质在固态时,属于分子晶体的有_________,属于原子晶体的________,属于离子晶体的有__________(以上均填序号)
①金刚石 ②氩 ③水晶 ④水银 ⑤氟化钙 ⑥P4 ⑦苯
(2)某常见固体能导电,质软,它可能属于__________
A.分子晶体 B.原子晶体 C.离子晶体 D.金属晶体 E.混合晶体
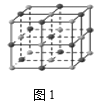
(3)在氯化钠晶体(见图1)中,每个钠离子与__________个最近且等距离的氯离子以________ 键相结合,与每个氯离子最近的且等距离的氯离子有 _______ 个。由于晶体中离子按一定的规律排列,必然造就了一颗完美晶体特定的几何外形,其中氯化钠单晶的宏观外形为_______ 。
【答案】②⑥⑦ ①③ ⑤ DE 6 离子 12 立方体
【解析】
根据构成晶体微粒的结构特点判断晶体类型;根据所给物质的性质特点判断属于晶体类型;根据所给NaCl晶体的图示,结合Na、Cl所处的位置,以此解答相关问题。
(1)①金刚石是碳原子间通过共价键构成的空间网状结构,为原子晶体;②氩是惰性气体,属于单原子分子,为分子晶体;③水晶的成分为SiO2,SiO2是Si原子与O原子通过共价键构成的空间网状结构,为原子晶体;④水银为金属晶体;⑤氟化钙是钙离子与氟离子之间形成离子键,属于离子化合物,为离子晶体;⑥P4是分子间通过分子间作用力结合形成的晶体,为分子晶体;⑦苯是分子间通过分子间作用力结合形成的晶体,为分子晶体;由上分析可知,属于分子晶体的有②⑥⑦,属于原子晶体有①③,属于离子晶体的有⑤;
答案为②⑥⑦,①③,⑤。
(2)固体能导电,质软,存在自由移动的电子,为金属晶体的特征,则该固体为金属晶体,还可能为石墨,属于混合晶体;
答案为:DE。
(3)由图知,在氯化钠晶体中,钠离子在体心和棱心位置,氯离子在顶点和面心位置,1个钠离子与6个氯离子构成正八面体,所以每个钠离子与6个最近且等距离的氯离子以离子键结合,与每个氯离子最近的且等距离的氯离子有12个,晶胞为面心立方,单晶的外观为立方体;
答案为:6,离子,12,立方体。

【题目】I.某温度时,在一个2L的密闭容器中,X、Y、Z三种气态物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:

①该反应的化学方程式为____________________________。
②从开始至2min,Z的平均反应速率为________________。
③若要提高X的转化率,请提出两条合理措施_______________________________、____________________________。
II.某探究性学习小组用相同质量的锌和相同浓度的足量的稀盐酸反应得到实验数据如表所示:
实验编号 | 锌的状态 | 反应温度/℃ | 收集100mL氢气 所需时间/s |
Ⅰ | 薄片 | 15 | 200 |
Ⅱ | 薄片 | 25 | 90 |
Ⅲ | 粉末 | 25 | 10 |
①该实验的目的是探究__________、__________对锌和稀盐酸反应速率的影响;
②实验Ⅰ和Ⅱ表明__________,化学反应速率越大;
③能表明固体的表面积对反应速率有影响的实验编号是 ______ 和 ______ 。
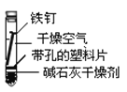
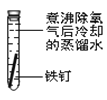
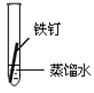
【题目】某课外小组同学对不同条件下铁钉的锈蚀进行了实验。
实验序号 | ① | ② | ③ | ④ |
实验 内容 |
|
|
|
|
一周后观察:
(1)铁钉被腐蚀程度最大的是___(填实验序号)。
(2)实验③中主要发生的是____(填“化学腐蚀”或“电化学腐蚀”)。
(3)烧过菜的铁锅未及时洗净(含氯化钠的残留液),第二天便出现红棕色锈斑,试写出有关的电极反应式: 负极____;
(4)根据上述实验,你认为铁发生电化学腐蚀的条件是____。
(5)据资料显示,全世界每年因腐蚀而报废的金属材料相当于其年产量的20%以上。为防护金属被腐蚀可采取的措施有___(填序号)。
①健身器材刷油漆 ②自行车钢圈镀铬 ③将钢管用导线与镁条连接 ④将钢管用导线与碳棒连接
【题目】Ⅰ.能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
已知:C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
H2(g)+![]() O2(g)===H2O(g) ΔH2=-241.8 kJ·mol-1
O2(g)===H2O(g) ΔH2=-241.8 kJ·mol-1
CO(g)+![]() O2(g)===CO2(g) ΔH3=-283.0 kJ·mol-1
O2(g)===CO2(g) ΔH3=-283.0 kJ·mol-1
则煤气化主要反应C(s)+H2O(g)=CO(g)+H2(g)的ΔH=____________________。
Ⅱ.为了减少CO的排放,某环境研究小组以CO和H2为原料合成清洁能源二甲醚(DME),反应如下:4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g) ΔH=-198 kJ·mol-1。
CH3OCH3(g)+H2O(g) ΔH=-198 kJ·mol-1。
(1)如图所示能正确反映平衡常数K随温度变化关系的曲线为________(填曲线标记字母),其判断理由是____________。

(2)在一定温度下,向2.0 L固定容积的密闭容器中充入2 mol H2和1 mol CO,经过一段时间后,反应4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g)达到平衡。反应过程中测得的部分数据见下表:
CH3OCH3(g)+H2O(g)达到平衡。反应过程中测得的部分数据见下表:
时间/min | 0 | 20 | 40 | 80 | 100 |
n(H2)/mol | 2.0 | 1.4 | 0.85 | 0.4 | — |
n(CO)/mol | 1.0 | — | 0.425 | 0.2 | 0.2 |
n(CH3OCH3)/mol | 0 | 0.15 | — | — | 0.4 |
n(H2O)/mol | 0 | 0.15 | 0.2875 | 0.4 | 0.4 |
①0~20 min的平均反应速率v(CO)=__________________mol·L-1·min-1;
②达到平衡时,H2的转化率为__________________;
③在上述温度下,该反应的平衡常数K=______________________;
④能表明该反应达到平衡状态的是________(填序号);
A CO的转化率等于H2O的产率 B 混合气体的平均相对分子质量不变
C v(CO)与v(H2)的比值不变 D 混合气体的密度不变
⑤在上述温度下,向平衡后的2 L容器中再充入0.4 mol H2和0.4 mol CH3OCH3(g),则化学平衡________移动(填“向左”“向右”或“不”)。