题目内容
16. (1)炒过菜的铁锅未及时洗净,不久便会因腐蚀而出现红褐色锈斑.请回答:铁锅的锈蚀是吸氧腐蚀(填“析氢”或“吸氧”).写出铁锅腐蚀正极的电极反应式:2H2O+O2+4e-=4OH-
(1)炒过菜的铁锅未及时洗净,不久便会因腐蚀而出现红褐色锈斑.请回答:铁锅的锈蚀是吸氧腐蚀(填“析氢”或“吸氧”).写出铁锅腐蚀正极的电极反应式:2H2O+O2+4e-=4OH-(2)某同学用碳棒、铜棒和稀硫酸为原材料,实现了在通常条件下不能发生的反应:Cu+H2SO4(稀)=CuSO4+H2↑.
请在方框中画出能够实验这一反应的装置图.
分析 (1)中性或弱酸性条件下,钢铁发生吸氧腐蚀;铁、碳和电解质溶液构成原电池,碳作正极,正极上氧气得电子发生还原反应;
(2)要实现Cu+H2SO4(稀)═CuSO4+H2↑,应形成电解池反应,铜为阳极,碳为阴极,阳极发生Cu-2e-=Cu2+,阴极发生2H++2e-=H2↑.
解答 解:(1)弱酸或中性条件下,钢铁发生吸氧腐蚀;铁、碳和电解质溶液构成原电池,碳作正极,正极上氧气得电子发生还原反应,电极反应式为:2H2O+O2+4e-=4OH-,故答案为:吸氧;2H2O+O2+4e-=4OH-.
(2)要实现Cu+H2SO4(稀)═CuSO4+H2↑,应形成电解池反应,铜为阳极,碳为阴极,阳极发生Cu-2e-=Cu2+,阴极发生2H++2e-=H2↑,则可发生Cu+H2SO4(稀)$\frac{\underline{\;通电\;}}{\;}$CuSO4+H2↑,装置图为 ,故答案为:
,故答案为: .
.
点评 本题考查了金属的电化学腐蚀及电解池原理,侧重于电解池装置的设计,明确钢铁所处环境的酸碱性即可确定其电化学腐蚀类型,难度不大.

练习册系列答案
 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案
相关题目
6.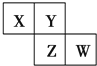 X、Y、Z、W均为短周期元素,在周期表中位置如图,Y原子的最外层电子数是其次外层电子数的3倍.下列说法正确的是( )
X、Y、Z、W均为短周期元素,在周期表中位置如图,Y原子的最外层电子数是其次外层电子数的3倍.下列说法正确的是( )
 X、Y、Z、W均为短周期元素,在周期表中位置如图,Y原子的最外层电子数是其次外层电子数的3倍.下列说法正确的是( )
X、Y、Z、W均为短周期元素,在周期表中位置如图,Y原子的最外层电子数是其次外层电子数的3倍.下列说法正确的是( )| A. | X、Y、Z的原子半径大小:X>Y>Z | |
| B. | Y、Z的气态氢化物中,前者更稳定 | |
| C. | Z、W的最高价氧化物对应水化物的酸性,前者更强 | |
| D. | X、W的气态氢化物相互反应,生成物中只含离子键不含共价键 |
4.关于如图所示装置的叙述,正确的是( )
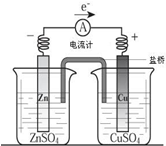

| A. | 铜离子在铜片表面被还原 | B. | 铜是阳极,铜片上有气泡产生 | ||
| C. | 铜片质量逐渐减少 | D. | 电流从锌片经导线流向铜片 |
11.NA代表阿伏加德罗常数的数值.下列有关NA的叙述中,正确的是( )
| A. | 1 mol 任何物质所含的分子数均为NA个 | |
| B. | 14 g氮气所含的N原子数为NA个 | |
| C. | 标准状况下,22.4 L水所含的H2O分子数为NA个 | |
| D. | 在钠与氯气的反应中,1 mol钠失去电子的数目为2 NA个 |
8.如图是一些常见有机物的转化关系,关于反应①~⑦的说法不正确的是( )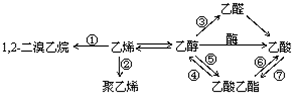

| A. | 反应①是加成反应 | B. | 只有反应②是加聚反应 | ||
| C. | 只有反应⑦是取代反应 | D. | 反应④⑤⑥⑦是取代反应 |
5.已知Ksp(BaSO4 )=1.1×10-10,Ksp(BaCO3)=2.5×10-9.下列说法中不正确的是( )
| A. | BaSO4比BaCO3溶解度小,所以,BaCO3可以转化为BaSO4 | |
| B. | BaCO3、BaSO4均不溶于水,所以都可以做钡餐试剂 | |
| C. | 向Na2CO3溶液中加入BaCl2和Na2SO4,当两种沉淀共存时,$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}$=4.4×10-2 | |
| D. | 常温下,BaCO3若要在Na2SO4溶液中开始转化为BaSO4,则Na2SO4的浓度必须不低于 2.2×10-6 mol•L-1 |
6.下列说法不正确的是( )
| A. | 法国化学家维勒首次提出有机化学的概念;德国化学家贝采里乌斯由氰酸铵合成了尿素,首次打破了有机物和无机物的界限 | |
| B. | 李比希用燃烧法来测定有机化合物中碳氢元素质量分数 | |
| C. | 用核磁共振氢谱和红外光谱法可以区别乙醇和二甲醚(CH3OCH3) | |
| D. | 用“同位素示踪法”是研究有机化学反应历程的手段之一 |
 如图为实验室制备乙烯的装置图,请回答:
如图为实验室制备乙烯的装置图,请回答: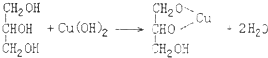 .
. +HCO3-→
+HCO3-→ +H2O+CO2↑.
+H2O+CO2↑.