题目内容
1.试回答下列问题(温度均为25℃时):(1)将0.2mol/L HB溶液与0.1mol/LMOH溶液等体积混合,测得混合溶液的pH=4,则0.2mol/L的 N aB溶液的pH为>7.(填“>”、“<”或“=”)
(2)pH=13的Ba(OH)2溶液a L与pH=3的HCl溶液b L混合.若所得混合溶液呈中性,则a:b=1:100;
(3)检验牙膏中含有甘油的试剂是新制Cu(OH)2,实验现象绛蓝色溶液;有关反应的化学方程式
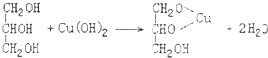 .
.(4)用离子方程式解释
①NaAlO2溶液的碱性:AlO2-+2H2O=Al(OH)3+OH-.
②阿司匹林粗产品中加入碳酸氢钠粉溶液:
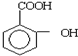 +HCO3-→
+HCO3-→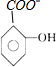 +H2O+CO2↑.
+H2O+CO2↑.
分析 (1)HB过量,反应后溶液中HB的浓度为0.05mol/L,而溶液的pH=4,说明HB只能部分电离出氢离子,则HB为弱酸,NaB为强碱弱酸盐,溶液呈碱性;
(2)根据反应后溶液为中性可知:n(H+)=n(OH-),据此列式计算;
(3)丙三醇能够与新制的氢氧化铜反应生成绛蓝色溶液: ,据此进行解答;
,据此进行解答;
(4)①偏铝酸根离子部分水解生成氢氧化铝和氢氧根离子,溶液呈碱性;
②阿司匹林中含有羧基,羧基能够与碳酸氢根离子反应生成二氧化碳气体,酚羟基不与碳酸氢根离子反应.
解答 解:(1)将0.2mol/L HB溶液与0.1mol/LMOH溶液等体积混合,则HB过量,反应后溶液中HB的浓度为0.05mol/L,而溶液的pH=4,说明HB只能部分电离出氢离子,则HB为弱酸,NaB为强碱弱酸盐,溶液呈碱性,其pH>7,
>
(2)pH=13的Ba(OH)2溶液 a L与pH=3的HCl溶液bL混合.若所得混合溶液呈中性,则:n(H+)=n(OH-),
即:0.1mol/L×2×aL=0.001mol/L×2×bL,
则:a:b=1:100,
故答案为:1:100;
(3)甘油为丙三醇,丙三醇能够与新制的氢氧化铜反应生成绛蓝色溶液,反应方程式为: ,据此可检验牙膏中的甘油,
,据此可检验牙膏中的甘油,
故答案为:; ;
;
(4)①偏铝酸根离子在溶液中部分水解:AlO2-+2H2O=Al(OH)3+OH-,导致溶液呈碱性,
故答案为:AlO2-+2H2O=Al(OH)3+OH-;
②阿司匹林与碳酸氢钠反应生成 、二氧化碳气体和水,反应的离子方程式为:
、二氧化碳气体和水,反应的离子方程式为: +HCO3-→
+HCO3-→ +H2O+CO2↑,
+H2O+CO2↑,
故答案为: +HCO3-→
+HCO3-→ +H2O+CO2↑.
+H2O+CO2↑.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算,题目难度中等,涉及溶液pH的计算、酸碱混合的定性判断、离子方程式书写、盐的水解原理、物质检验等知识,试题知识点较多,充分考查学生灵活应用基础知识的能力,注意熟练掌握溶液酸碱性与溶液pH的关系及计算方法.

| A. | 葡萄糖能够发生银镜反应 | |
| B. | 米酒变酸的过程涉及了氧化反应 | |
| C. | 漂白液的有效成分是NaClO,可用于杀菌消毒 | |
| D. | 光导纤维、棉花、油脂、树脂都是由高分子化合物组成的物质 |
| A. | A是锌,B是铜,C为稀H2SO4 | B. | A是铜,B是锌,C为稀H2SO4 | ||
| C. | A是铁,B是银,C为AgNO3溶液 | D. | A是Ag,B是铁,C为AgNO3溶液 |
| A. | 汽油 | B. | 色拉油 | C. | 甘油 | D. | 煤油 |
| A. | 用纤维素制硝化纤维 | B. | 跟苯、浓硝酸作用制硝基苯 | ||
| C. | 溶解金属铜 | D. | 锌与酸制氢气 |
| A. | 用比室温约高10~20℃的水溶解明矾晶体得到饱和溶液 | |
| B. | 使明矾饱和溶液急速冷却 | |
| C. | 选用形状较为规则的小明矾晶体作晶核 | |
| D. | 结晶过程中,应将硬纸板盖住盛有饱和溶液的烧杯 |
| A. | 22.4 L | B. | 2.24 L | C. | 44.8 L | D. | 4.48 L |
 (1)炒过菜的铁锅未及时洗净,不久便会因腐蚀而出现红褐色锈斑.请回答:铁锅的锈蚀是吸氧腐蚀(填“析氢”或“吸氧”).写出铁锅腐蚀正极的电极反应式:2H2O+O2+4e-=4OH-
(1)炒过菜的铁锅未及时洗净,不久便会因腐蚀而出现红褐色锈斑.请回答:铁锅的锈蚀是吸氧腐蚀(填“析氢”或“吸氧”).写出铁锅腐蚀正极的电极反应式:2H2O+O2+4e-=4OH-