题目内容
【题目】将Al条插入6 mol·L-1盐酸中,反应过程中产生H2速率变化情况如图1所示。下列说法错误的是
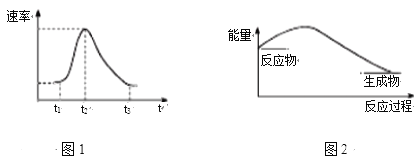
A. 图1中开始阶段产生气体速率较慢可能是因为Al条表面有氧化膜
B. 图1中影响t1~t2段速率变化的主要原因是反应放热导致溶液温度升高
C. 图1中影响t2~t3速率变化的主要因素是c(Cl-)
D. 图2可以表示该反应过程的能量变化
【答案】C
【解析】
图1反应速率与表面积大小、温度、浓度有关,t2之前反应速率与温度升高有关,t2之后反应速率与浓度减小有关。图2,该反应是放热反应,能量变化是反应物的总能量高于生成物的总能量;
A、图1中开始阶段产生气体速率较慢可能是因为Al条表面有氧化膜,氧化膜与酸反应时没有氢气产生,故A正确;
B、图1中影响t1~t2段速率变化的主要原因是反应放热,导致溶液温度升高,故B正确;
C、t2后随反应进行,2Al+6H+=2Al3++3H2↑,氢离子浓度不断减小,影响反应速率的主要因素是氢离子浓度减小,故C错误;
D、该反应是放热反应,能量变化是反应物的总能量高于生成物的总能量,所以图2符合,故D正确;
故选C。

练习册系列答案
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目




